题目内容
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是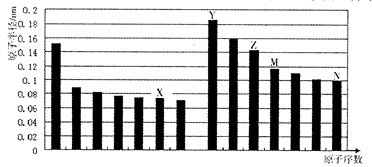
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的稳定性相比,前者较弱 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
D
解析试题分析:由图可知:X为F元素;Y为Na元素;Z为Al元素;M为Si元素;N为Cl元素。 A.Al、Cl 都是第三周期的元素。Al3+核外电子排布为2、8,而Cl-的核外电子排布为2、8、8.离子核外的电子层数越多,离子半径越大。所以离子半径: Al3+<Cl-。错误。B.非金属性:F>Cl .元素的非金属性越强,其对应的氢化物的稳定性就越强。所以稳定性HF>HCl 。错误。C. SiF4既不能与酸发生反应,也不能与强碱发生反应。错误。D.Al2O3是两性氧化物,既能与强碱发生反应:Al2O3+2NaOH=NaAlO2+2H2O; 也能与强酸发生反应:Al2O3+6HCl=2AlCl3+3H2O;正确。
考点:考查元素周期表、元素周期律、元素的推断几原子半径的大小比较和元素的性质的知识。

练习册系列答案
相关题目
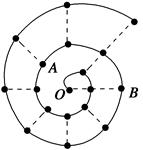
根据不同的研究目的,可以编制成不同的元素周期表。将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”元素周期表,图中每个“.”代表一种元素,其中P点代表氢元素(图中的字母不表示元素符号)。下列说法正确的是
| A.Y点元素对应的氢化物比z点元素对应的氢化物更稳定 |
| B.虚线相连的两个点元索处于同一族 |
| C.比Y点原子序数小8的元素,它的最高氧化物对应的水化物是一种弱酸 |
D.K、L、X三种元素的离子半径大小顺序是X3+> >K2- >K2- |
X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z位于同一主族,三种元素可以形成原子个数比为1∶1∶1的化合物W。下列推测正确的是 ( )。
| A.元素Z的氧化物一定属于碱性氧化物 |
| B.原子半径:X<Y<Z |
| C.三种元素中,Y的金属性最强 |
| D.Y、Z都能形成含氧酸,且前者的酸性比后者强 |
下表是元素周期表的一部分,有关说法正确的是( )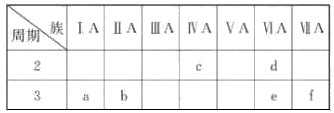
| A.e的氢化物比d的氢化物稳定 |
| B.a、b、e三种元素的原子半径:e>b>a |
| C.6种元素中,c元素单质的化学性质最活泼 |
| D.c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
X、Y、Z、T四种原子序数递增的短周期元素,其部分性质或结构如下:
| 元素编号 | 元素性质或原子结构 |
| X | 形成的简单阳离子核外无电子 |
| Y | 元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应 |
| Z | 元素在周期表的族序数等于周期序数的3倍 |
| T | 同周期元素中形成的简单离子半径最小 |
A.原子半径大小顺序:T>Z>Y>X
B.常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液反应生成氢气
C.X分别与Y、Z均可形成既含极性键又含非极性键的化合物
D.由X、Y和Z三种元素构成的强电解质,对水电离均起抑制作用
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中不正确的是( )
| A.原子半径:W>Z>Y>X |
| B.气态氢化物的稳定性:Y>Z |
| C.根据W单质与X的氢化物的置换反应可得非金属性:W>X |
| D.四种元素的单质中,Z的熔沸点最高 |