题目内容
某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
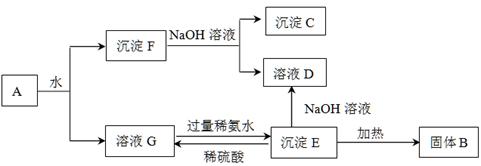
请回答下列问题。
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D、E 4种物质的化学式为:B_________、C_________、D_________、E_________。
(3)沉淀F与NaOH溶液反应的离子方程式为__________________________________。
沉淀E与稀硫酸反应的离子方程式为__________________________________________。
溶液G与过量稀氨水反应的化学方程式为______________________________________。

请回答下列问题。
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D、E 4种物质的化学式为:B_________、C_________、D_________、E_________。
(3)沉淀F与NaOH溶液反应的离子方程式为__________________________________。
沉淀E与稀硫酸反应的离子方程式为__________________________________________。
溶液G与过量稀氨水反应的化学方程式为______________________________________。
(1)过滤 (2)Al2O3 Fe2O3 NaAlO2 Al(OH)3
(3)Al2O3+2OH-=2AlO2—+H2O
Al(OH)3+3H+=Al3++3H2O
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4
解析:本题主要考查铝的化合物的性质。Al、Al2O3、Al(OH)3的反应多发生在酸性或碱性环境中;溶液的酸碱性决定了铝元素的成盐形式为Al3+或AlO2—。
(3)Al2O3+2OH-=2AlO2—+H2O
Al(OH)3+3H+=Al3++3H2O
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4
解析:本题主要考查铝的化合物的性质。Al、Al2O3、Al(OH)3的反应多发生在酸性或碱性环境中;溶液的酸碱性决定了铝元素的成盐形式为Al3+或AlO2—。
试题分析:A溶于水得沉淀和溶液,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液是硫酸铝溶液(即G),沉淀F是氧化铝和氧化铁,将沉淀F溶于过量氢氧化钠溶液中,氧化铝能和氢氧化钠反应,氧化铁和氢氧化钠不反应,所以沉淀C是氧化铁,溶液D是偏铝酸钠。硫酸铝和氨水反应生成氢氧化铝和硫酸铵,所以溶液沉淀E是氢氧化铝,将沉淀氢氧化铝加热得到B,B是氧化铝。
(1)分离溶液和固体的操作是过滤。
(2)由以上分析得,B、C、D、E4种物质分别为Al2O3、Fe2O3、NaAlO2、Al(OH)3。
(3) 沉淀F是氧化铝和氧化铁,将沉淀F溶于过量氢氧化钠溶液中,氧化铝能和氢氧化钠反应,氧化铁和氢氧化钠不反应,反应的离子方程式为Al2O3+2OH-=2AlO2—+H2O。沉淀E是氢氧化铝,与稀硫酸反应的离子方程式为Al(OH)3+3H+=Al3++3H2O。溶液G是硫酸铝溶液,与过量稀氨水反应的化学方程式为Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4。
点评:本题为框图型物质推断题,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质,然后顺推或逆推或由两边向中间推得出其他物质。

练习册系列答案
相关题目
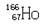 的原子核内的中子数与核外电子数之差是
的原子核内的中子数与核外电子数之差是 O2气体, 不久前在我国兰州近代物理研究所制备成功, 1 mol 这种
O2气体, 不久前在我国兰州近代物理研究所制备成功, 1 mol 这种