题目内容
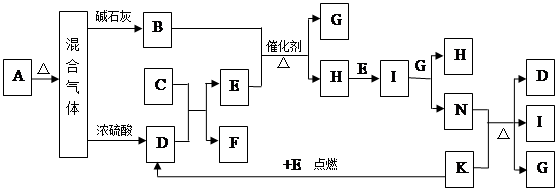
下图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质而I是红棕色的气态氧化物。固态物质A加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D。各物质间的转化关系如下图所示:
请回答下列问题:
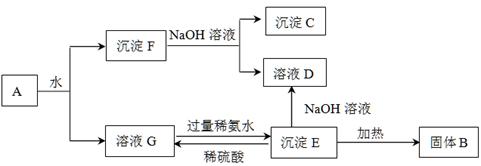
(1) 写出实验室检验A物质中含有的阳离子的方法 。
(2) B与E反应得到1molH,则此时转移电子的物质的量为 mol。
(3) 写出实验室制取B的化学方程式 。
(4) 写出N的稀溶液与过量的铁粉反应的离子方程式 。
(5) 若混合气体通过碱石灰得到的气体B与通过浓硫酸得到的气体D的物质的量之比是8∶5,则用物质的量的关系表示此固体A的组成为 。

请回答下列问题:
(1) 写出实验室检验A物质中含有的阳离子的方法 。
(2) B与E反应得到1molH,则此时转移电子的物质的量为 mol。
(3) 写出实验室制取B的化学方程式 。
(4) 写出N的稀溶液与过量的铁粉反应的离子方程式 。
(5) 若混合气体通过碱石灰得到的气体B与通过浓硫酸得到的气体D的物质的量之比是8∶5,则用物质的量的关系表示此固体A的组成为 。
(10分)(1) 取适量A物质放入试管中,加入适量NaOH等强碱溶液并加热,若能产生使湿润的红色石蕊试纸变蓝的气体,则证明含有铵根离子。(2分)
(2) 5(2分) (3) Ca(OH)2 + 2NH4Cl CaCl2 + 2H2O +2 NH3↑(2分)
CaCl2 + 2H2O +2 NH3↑(2分)
(4) 3Fe + 8H+ + 2NO3- =2NO↑+3Fe2+ + 4H2O(2分)
(5) NH4HCO3和(NH4)2CO3按物质的量之比为2:3混合而成。(2分)
(2) 5(2分) (3) Ca(OH)2 + 2NH4Cl
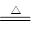 CaCl2 + 2H2O +2 NH3↑(2分)
CaCl2 + 2H2O +2 NH3↑(2分) (4) 3Fe + 8H+ + 2NO3- =2NO↑+3Fe2+ + 4H2O(2分)
(5) NH4HCO3和(NH4)2CO3按物质的量之比为2:3混合而成。(2分)
试题分析:A、C、F、K是固体;E是常见的气体单质,I是红棕色的气态氧化物。固态物质A加热后生成的气体混合物,若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D,E是常见的气体单质,可以初步推断为O2,I是红棕色的气态氧化物判断为NO2,依据转化关系可知H为NO,G为H2O,N为HNO3,B为NH3。固态物质A加热后生成的气体混合物,若通过碱石灰只剩余气体B进一步确定B为NH3,若通过浓硫酸则只剩余气体D,说明D为酸性气体且无还原性,推测D为CO2,根据反应:N(HNO3)+K(C)=D(CO2)+I(NO2)+G(H2O),C为Na2O2,F为(Na2CO3),所以A受热分解生成碱性气体NH3和酸性气体CO2,证明A为碳酸铵盐。
(1)实验室检验A物质中含有的阳离子是NH4+的方法:取适量A物质放入试管中,加入适量NaOH等强碱溶液并加热,若能产生使湿润的红色石蕊试纸变蓝的气体,则证明含有铵根离子。
(2)氨气发生催化氧化的方程式是4NH3+5O2
 4NO+6H2O,所以生成1molNO转移电子的物质的量是2-(-3)=5mol。
4NO+6H2O,所以生成1molNO转移电子的物质的量是2-(-3)=5mol。(3)实验室制取B(NH3)的化学方程式为:Ca(OH)2 + 2NH4Cl
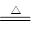 CaCl2 + 2H2O +2 NH3↑。
CaCl2 + 2H2O +2 NH3↑。(4)N的稀溶液HNO3与过量的铁粉反应生成亚铁盐,反应的离子方程式为:3Fe + 8H+ + 2NO3- =2NO↑+3Fe2+ + 4H2O。
(5)混合气体通过碱石灰得到的气体B为NH3与通过浓硫酸得到的气体D(CO2)的物质的量之比是8:5,依据化学反应的原子守恒得到,若是碳酸氢铵,铵根离子和碳酸氢根离子物质的量之比为1:1;若为碳酸铵,铵根离子和碳酸根离子物质的量为2:1,混合气体中氨气和二氧化碳物质的量之比为8:5,介于1:1和2:1间,所以判断A为碳酸铵和碳酸氢铵的混合物。设碳酸氢铵和碳酸铵的物质的量分别是x和y,则
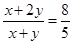 ,解得x:y=2:3,则用物质的量的关系表示此固体A的组成为NH4HCO3和(NH4)2CO3按物质的量之比为2:3混合而成。
,解得x:y=2:3,则用物质的量的关系表示此固体A的组成为NH4HCO3和(NH4)2CO3按物质的量之比为2:3混合而成。点评:该题综合性强,难度较大,主要是考查了物质转化关系的应用和物质性质的应用,主要考查铵根离子检验、化学方程式的书写、离子方程式的产物判断和书写、物质组成的计算分析判断。该类试题需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等

练习册系列答案
相关题目