题目内容
下列说法中正确的是:( )
①所有基态原子的核外电子排布都遵循构造原理
②同一周期从左到右,元素的第一电离能、电负性都是越来越大
③金属键、共价键和氢键都具有相同的特征:方向性和饱和性
④所有的配合物都存在配位键,所有含配位键的化合物都是配合物
⑤所有含极性键的分子都是极性分子
⑥所有金属晶体中都含有金属键
⑦所有的金属晶体熔点肯定高于分子晶体.
①所有基态原子的核外电子排布都遵循构造原理
②同一周期从左到右,元素的第一电离能、电负性都是越来越大
③金属键、共价键和氢键都具有相同的特征:方向性和饱和性
④所有的配合物都存在配位键,所有含配位键的化合物都是配合物
⑤所有含极性键的分子都是极性分子
⑥所有金属晶体中都含有金属键
⑦所有的金属晶体熔点肯定高于分子晶体.
| A、③⑥⑦ | B、⑥ | C、③④⑤ | D、①②⑥⑦ |
分析:①构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序,原子轨道充满或半充满时原子的能量处于最低状态不遵循构造原理;
②电负性是元素的原子在化合物中吸引电子能力的标度,电负性可以判断元素的金属性和非金属性;第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量;
③共价键和氢键都具有方向性和饱和性,金属键没有;
④含配位键的不一定是配合物,但配合物中一定含有配位键;
⑤含极性键的分子中,若结构对称,正负电荷重心重合,即为非极性分子;
⑥金属离子之间通过自由电子而产生的强烈相互作用;
⑦金属晶体熔点不一定高于分子晶体.
②电负性是元素的原子在化合物中吸引电子能力的标度,电负性可以判断元素的金属性和非金属性;第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量;
③共价键和氢键都具有方向性和饱和性,金属键没有;
④含配位键的不一定是配合物,但配合物中一定含有配位键;
⑤含极性键的分子中,若结构对称,正负电荷重心重合,即为非极性分子;
⑥金属离子之间通过自由电子而产生的强烈相互作用;
⑦金属晶体熔点不一定高于分子晶体.
解答:解:①原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,但轨道充满或半充满时,能量较小,如Cu:3d104s1,Cr:3d54s1,不遵循构造原理,故①错误;
②同周期从左到右,元素的非金属性依次增强,元素的第一电离能越来越大,虽电负性依次增强,但稀有气体除外,故②错误;
③一个金属阳离子可以在任何方向吸引相反电荷的电子,无方向性和饱和性.共价键形成的本质就是电子云的重叠,电子云重叠越多,分子越稳定.两个原子的未成对电子,只有自旋相反,才能配对形成一个共价键.所以共价键就具有饱和性和方向性.氢键饱和性,是指一个氢原子只能和一个氧(氟,氮)原子,形成氢键,而不能同时和多个原子形成氢键;方向性,是指氢键是有一定键角;金属键没有方向性和饱和性,故③错误;
④含配位键的不一定是配合物,如铵根离子不是络离子,氯化铵不是配合物而是离子化合物,故④错误;
⑤二氧化碳、甲烷等分子含有极性共价键,但结构对称为非极性分子,故⑤错误;
⑥金属键是金属阳离子和自由电子这两种带异性电荷的微粒间的强烈相互作用,所有金属晶体中都含有金属键,故⑥正确;
⑦汞的熔点(-60℃)比冰(0℃)低,汞是液态金属,属于金属晶体,而冰是固态的水,它属于分子晶体,金属晶体汞的熔点低于分子晶体冰,故⑦错误;
故选B.
②同周期从左到右,元素的非金属性依次增强,元素的第一电离能越来越大,虽电负性依次增强,但稀有气体除外,故②错误;
③一个金属阳离子可以在任何方向吸引相反电荷的电子,无方向性和饱和性.共价键形成的本质就是电子云的重叠,电子云重叠越多,分子越稳定.两个原子的未成对电子,只有自旋相反,才能配对形成一个共价键.所以共价键就具有饱和性和方向性.氢键饱和性,是指一个氢原子只能和一个氧(氟,氮)原子,形成氢键,而不能同时和多个原子形成氢键;方向性,是指氢键是有一定键角;金属键没有方向性和饱和性,故③错误;
④含配位键的不一定是配合物,如铵根离子不是络离子,氯化铵不是配合物而是离子化合物,故④错误;
⑤二氧化碳、甲烷等分子含有极性共价键,但结构对称为非极性分子,故⑤错误;
⑥金属键是金属阳离子和自由电子这两种带异性电荷的微粒间的强烈相互作用,所有金属晶体中都含有金属键,故⑥正确;
⑦汞的熔点(-60℃)比冰(0℃)低,汞是液态金属,属于金属晶体,而冰是固态的水,它属于分子晶体,金属晶体汞的熔点低于分子晶体冰,故⑦错误;
故选B.
点评:本题考查原子结构与化学键、晶体类型等知识,侧重于考查学生的分析能力和综合运用化学知识的能力,题目难度中等,本题注意根据电离能判断金属性、非金属性的强弱,理解各化学键为解答该题的关键.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、进行钠的有关性质实验时,用剩的钠应放回原试剂瓶 | B、常用25.00 ml 碱式滴定管准确量取20.00 ml KMnO4溶液 | C、用湿润的淀粉碘化钾试纸可以鉴别NO2和Br2蒸气 | D、某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
| A、两种物质的阴离子半径都比阳离子半径小 | B、溶于水,所得溶液都能使无色酚酞变红 | C、与水反应时,水都做氧化剂 | D、与盐酸反应都只生成一种盐 |
下列说法中正确的是( )
| A、用碱石灰除去氯气中的水 | B、碘化银是重要的感光材料,溴化银可用于人工降雨 | C、过氧化钠可用作潜艇里氧气的来源 | D、焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察 |
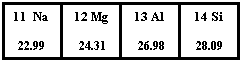 如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )
如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )| A、Si元素的名称是硅,其核电荷数为14 | B、Mg原子的结构示意图是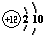 | C、Al的相对原子质量是26.98g | D、它们都属于金属元素 |
下列说法中正确的是( )
| A、O、Na、S元素的原子半径依次增大 | B、KOH、Mg(OH)2、Ba(OH)2的碱性依次增强 | C、H2SO4、H3PO4、HClO4的酸性依次增强 | D、F2、Cl2、Br2、I2的氧化性依次减弱 |