题目内容
【题目】如图表示工业SO2催化氧化反应过程中的速率(v)与时间(t)的关系曲线,下列叙述正确的是( )

A. t2-t3,气体总物质的量保持不变(已知该条件下SO3为气体)
B. t2时,v(SO2)正和v(O2)逆相等且等于0
C. t1时刻,只有正方向的反应没有逆方向的反应
D. t2-t3,处于静止状态,反应不再发生
【答案】A
【解析】该条件下SO3为气体,则t2-t3,已经达到平衡状态,气体总物质的量保持不变,A项正确;t2时,达到平衡状态,v(SO2)正和v(O2)逆之比等于2:1,处于动态平衡,故v(SO2)正和v(O2)逆的速率不等于0,B项错误;t1时刻反应未达到平衡状态,正方向的反应和逆方向的反应同时存在,C项错误;化学平衡为动态平衡,反应仍在进行,D项错误。

【题目】下表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第_____周期,第_____族,其基态原子的核外电子排布式是________。
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)__________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成________个σ键,________个π键。
(4)I与氢元素形成的10电子分子X的空间构型为________;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为________,其中X与Cu2+之间以_____________键结合。
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a._________________________________。
b._________________________________。
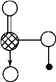
(6) 如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为_________,若晶胞边长为a cm,则晶体的密度为_______________(用含a、NA的代数式表示)(g/mL)。

