题目内容
【题目】根据题意填空:
(1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(Lmin)、②vC=0.5mol/(Lmin)、③vB=0.5mol/(Lmin),三种情况下该反应速率由大到小的关系是 . (用序号表示)
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: 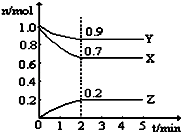
①该反应的化学方程式为 .
②反应开始至2min,以气体Z表示的平均反应速率为 .
③2min反应达平衡容器内混合气体的平均相对分子质量比起始时(填“大”,“小”或“相等”下同),混合气体密度比起始时 .
④上述反应,在第2min时,X的转化率为 .
⑤将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),则原混合气体中a:b= .
【答案】
(1)③>①>②
(2)3X+Y?2Z;0.02mol?L﹣1?min﹣1;大;相等;30%;5:3
【解析】解:(1)单位相同条件下,不同物质的化学反应速率与其计量数的比值越大该反应速率越大,① ![]() =
= ![]() =
= ![]() mol/(Lmin)②
mol/(Lmin)② ![]() =
= ![]() mol/(Lmin)=0.25 mol/(Lmin)、③
mol/(Lmin)=0.25 mol/(Lmin)、③ ![]() =0.5mol/(Lmin),三种情况下该反应速率由大到小的关系是③>①>②, 故答案为:③>①>②;(2)①根据图知,随着反应的进行,X、Y的物质的量减少而Z的物质的量增加,则X和Y是反应物、Z是生成物,同一可逆反应中同一段时间内各物质的物质的量变化量之比等于其计量数之比,△n(X)=(1.0﹣0.7)mol=0.3mol、△n(Y)=(1.0﹣0.9)mol=0.1mol、△n(Z)=(0.2﹣0)mol=0.2mol,所以X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,所以该反应方程式为,故答案为:3X+Y2Z;②v(Z)=
=0.5mol/(Lmin),三种情况下该反应速率由大到小的关系是③>①>②, 故答案为:③>①>②;(2)①根据图知,随着反应的进行,X、Y的物质的量减少而Z的物质的量增加,则X和Y是反应物、Z是生成物,同一可逆反应中同一段时间内各物质的物质的量变化量之比等于其计量数之比,△n(X)=(1.0﹣0.7)mol=0.3mol、△n(Y)=(1.0﹣0.9)mol=0.1mol、△n(Z)=(0.2﹣0)mol=0.2mol,所以X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,所以该反应方程式为,故答案为:3X+Y2Z;②v(Z)= ![]() =
= ![]() =0.02mol/(L.min),故答案为:0.02 molL﹣1min﹣1;③该反应方程式为3X+Y2Z,反应前后气体总质量不变,但物质的量减小,容器体积不变,根据M=
=0.02mol/(L.min),故答案为:0.02 molL﹣1min﹣1;③该反应方程式为3X+Y2Z,反应前后气体总质量不变,但物质的量减小,容器体积不变,根据M= ![]() 知,反应前后混合气体相对分子质量增大、根据ρ=
知,反应前后混合气体相对分子质量增大、根据ρ= ![]() 知,反应前后混合气体密度不变,故答案为:大;相等;④在第2min时,X的转化率=
知,反应前后混合气体密度不变,故答案为:大;相等;④在第2min时,X的转化率= ![]() ×100%=
×100%= ![]() ×100%=30%,故答案为:30%;⑤反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),根据方程式知,参加反应的n(X)=1.5n(Z),参加反应的n(Y)=0.5n(Z),所以反应初始a=n(Z)+1.5n(Z)=2.5n(Z),b=n(Y)+0.5n(Z)=1.5n(Z),所以a:b=2.5n(Z):1.5n(Z)=5:3,故答案为:5:3.
×100%=30%,故答案为:30%;⑤反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),根据方程式知,参加反应的n(X)=1.5n(Z),参加反应的n(Y)=0.5n(Z),所以反应初始a=n(Z)+1.5n(Z)=2.5n(Z),b=n(Y)+0.5n(Z)=1.5n(Z),所以a:b=2.5n(Z):1.5n(Z)=5:3,故答案为:5:3.
(1)单位相同条件下,不同物质的化学反应速率与其计量数的比值越大该反应速率越大;(2)①根据图知,随着反应的进行,X、Y的物质的量减少而Z的物质的量增加,则X和Y是反应物、Z是生成物,同一可逆反应中同一段时间内各物质的物质的量变化量之比等于其计量数之比,据此反应书写方程式;②v(Z)= ![]() ;③该反应方程式为3X+Y2Z,反应前后气体总质量不变,但物质的量减小,根据M=
;③该反应方程式为3X+Y2Z,反应前后气体总质量不变,但物质的量减小,根据M= ![]() 、ρ=
、ρ= ![]() 判断相对分子质量、密度是否改变;④在第2min时,X的转化率=
判断相对分子质量、密度是否改变;④在第2min时,X的转化率= ![]() ×100%;⑤反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),根据方程式知,参加反应的n(X)=1.5n(Z),参加反应的n(Y)=0.5n(Z),所以反应初始a=n(Z)+1.5n(Z)=2.5n(Z),b=n(Y)+0.5n(Z).
×100%;⑤反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),根据方程式知,参加反应的n(X)=1.5n(Z),参加反应的n(Y)=0.5n(Z),所以反应初始a=n(Z)+1.5n(Z)=2.5n(Z),b=n(Y)+0.5n(Z).

【题目】除去下列括号内的杂质,所加试剂和操作均正确的是
选项 | 需除杂的物质 | 试剂 | 操作 |
A | Fe2O3(Al2O3) | Na OH溶液 | 过滤 |
B | CO2(HCl) | Na OH溶液 | 将气体通过洗气瓶 |
C | NaCl(Na2CO3) | 稀硫酸 | 蒸发结晶 |
D | Mg(Al) | 氨水 | 过滤 |
A. A B. B C. C D. D