题目内容
[化学-选修物质结构与性质]第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.
(1)Pt与Ni在周期表中位于同一族,写出基态Ni原子核外电子排布式 .
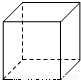
(2)金属Pt内部原子的堆积方式与铜及干冰中CO2相同,图正方体是Pt晶胞示意图,叙述Pt原子在晶胞中位置: .
(3)已知XeO3分子中氙原子上有1对孤对电子,则XeO3为 分子(填“极性”或“非极性”);XeO3分子中中心原子的杂化类型为 ;XeO3分子实际空间构型为
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是 .
【答案】分析:(1)Ni的原子序数为28,根据能量最低原理和洪特规则书写电子排布式;
(2)铜的堆积模型为最紧密堆积,配位数为12,铜原子位于顶点和面心,与二氧化碳分子晶胞结构相似;
(3)XeO3分子中含有3个δ键和一个孤电子对,为三角锥形分子,杂化方式为sp3杂化;
(4)根据HF含有氢键判断.
解答:解:(1)Ni的原子序数为28,根据能量最低原理和洪特规则可写出基态Ni原子核外电子排布式为1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)铜的堆积模型为最紧密堆积,配位数为12,铜原子位于顶点和面心,与二氧化碳分子晶胞结构相似,
故答案为:正方体的八个顶点和六个面心;
(3)XeO3分子中含有3个δ键和一个孤电子对,为三角锥形分子,结构不对称,为极性分子,杂化方式为sp3杂化
故答案为:极性;sp3;三角锥形;
(4)HF含有氢键,沸点较高,易液化,故答案为:HF.
点评:本题考查较为综合,涉及电子排布式的书写、晶胞结构、分子的极性以及氢键等知识,题目难度中等,本题注意常见金属的堆积模型,为易错点,也是易忽视的地方.
(2)铜的堆积模型为最紧密堆积,配位数为12,铜原子位于顶点和面心,与二氧化碳分子晶胞结构相似;
(3)XeO3分子中含有3个δ键和一个孤电子对,为三角锥形分子,杂化方式为sp3杂化;
(4)根据HF含有氢键判断.
解答:解:(1)Ni的原子序数为28,根据能量最低原理和洪特规则可写出基态Ni原子核外电子排布式为1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)铜的堆积模型为最紧密堆积,配位数为12,铜原子位于顶点和面心,与二氧化碳分子晶胞结构相似,
故答案为:正方体的八个顶点和六个面心;
(3)XeO3分子中含有3个δ键和一个孤电子对,为三角锥形分子,结构不对称,为极性分子,杂化方式为sp3杂化
故答案为:极性;sp3;三角锥形;
(4)HF含有氢键,沸点较高,易液化,故答案为:HF.
点评:本题考查较为综合,涉及电子排布式的书写、晶胞结构、分子的极性以及氢键等知识,题目难度中等,本题注意常见金属的堆积模型,为易错点,也是易忽视的地方.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质
 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]