题目内容
【题目】常温下,向浓度均为0.1 mol/L 体积均为10mL的两种一元酸(HX、HY)溶液中,分别滴入0.1 mol·L-1NaOH溶液,pH的变化曲线如图所示。下列说法错误的是
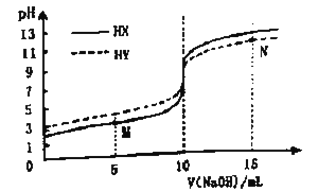
A. N点:c(Na+)=c(Y- )+c(HY)
B. M点:c(X-)>c(Na+)
C. 滴至pH=7时,消耗NaOH溶液的体积:HX>HY
D. 滴入10mLNaOH溶液时,溶液中水的电离程度:HX<HY
【答案】A
【解析】A. 据图可知,浓度均为0.1 mol/L的两种一元酸HX、HY溶液的pH都大于1,说明HX和HY均为弱酸,N点加入NaOH溶液的体积为15mL,NaOH与HY的物质的量之比为3:2,则根据物料守恒得2c(Na+)=3c(Y- )+3c(HY),故A错误;B. M点加入NaOH溶液的体积为5mL,根据反应方程式NaOH+HX=NaX+H2O可知,反应后所得溶液中HX和NaX的物质的量相等,此时溶液的pH<7,说明HX的电离程度大于X-的水解程度,所以c(X-)>c(Na+),故B正确;C. 据图可知,浓度均为0.1 mol/L的两种一元酸HX、HY溶液的pH(HX)<pH(HY),说明酸性HX>HY,因酸性越弱其对应的阴离子水解程度越大,所以滴至pH=7时,消耗NaOH溶液的体积:HX>HY,故C正确;D. 滴入10mLNaOH溶液时,HX和HY均恰好完全反应分别得到NaX、NaY溶液,因酸性HX>HY,则X-的水解程度小于Y-的水解程度,溶液中水的电离程度:HX<HY,故D正确;答案选A。

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目