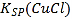题目内容
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。将溶液加水稀释至100 mL,溶液pH数值范围为___________,溶液中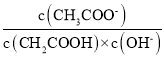 ____(填“增大”“减小”“不变”或“不能确定”)。
____(填“增大”“减小”“不变”或“不能确定”)。
(2)25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=______;
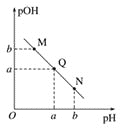
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。图中M、Q、N三点所示溶液中水的电离程度最大的点是___________。
【答案】3<pH<4 不变 11 Q
【解析】
(1)醋酸是弱酸加水稀释醋酸电离程度增大,溶液中存在离子积常数,结合比值关系和电离平衡常数分析;
(2)25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10-3mol/L;
(3)图象分析可知N点pH>pOH,溶液显碱性,M点pOH>pH,溶液显酸性,酸碱抑制水的电离,Q点pOH=pH,溶液显中性。
(1)25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3,溶液加水稀释至100mL,氢离子浓度减小,pH大于3,醋酸电离被促进又电离出氢离子,氢离子浓度减小小于稀释10倍后的H+浓度,则溶液pH小于4,溶液pH取值范围为:3<pH<4,溶液中离子浓度之比=
![]() ,电离平衡常数和离子积常数随温度变化,所以加水稀释溶液中
,电离平衡常数和离子积常数随温度变化,所以加水稀释溶液中 不变;
不变;
(2)25℃时,CH3COOH和NH3H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3H2O溶液)电离出的氢氧根离子浓度为10-3mol/L,溶液pH=11;
(3)图象分析可知N点pH>pOH,溶液显碱性,M点pOH>pH,溶液显酸性,酸碱抑制水的电离,Q点pOH=pH,溶液显中性,水的电离程度最大,故答案为:Q。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】某课题组从植物香料中分离出一种罕见的醇(醇A),其结构简式如下。

(1)根据课内所学知识,该醇可发生的反应包括:___(填字母序号)
A.与金属Na反应 B.与CuO反应
C.与浓盐酸反应 D.消去反应
I.该课题组设计了以醇A为原料制备某物质的合成路线。合成反应的第一步。拟使醇A与浓氢溴酸(质量分数47.6%)在90℃下充分反应,制备中间产物B。实验装置如图所示(夹持及加热仪器略去)。

已知:①HBr溶液受热时,HBr能否蒸发受到体系汇总含水量的影响。具体情况如下表。
| <47.6% | 47.6% | >47.6% |
先蒸发的物质 | 水先蒸发,直至比值升至47.6% | HBr与水按该比例一起蒸发、液化沸点124.3℃ | HBr先蒸发,直至比值降至47.6% |
②醇A、中间产物B的沸点均超过200℃。
(2)温度计1拟用于监控反应温度,温度计2拟用于监控实验中离开烧瓶的物质的沸点。两个温度计中,水银球位置错误的是___(填“温度计1”或“温度计2”)其水银球应___;
(3)实验时,冷凝水应从冷凝管的___(填“a口”或“b口”)流入。
II.将温度计位置调节好后,课题组成员依次进行如下操作:
①检验气密性,装入沸石;
②加入18.6g醇A(0.1mol)、17.0g47.6%氢溴酸(含8.1gHBr、0.1mol);
③开始加热,逐渐升温至反应温度。
(4)反应开始后,当温度计2的示数上升至39℃时,冷凝管末端持续有液体流出。反应结束时,共收集到无色液体7.0g。经检测,该液体为纯净物,标记为产物C。取0.7gC在氧气中充分燃烧,共收集到2.2gCO2、0.9gH2O。另取少量C进行质谱试验,结果如图所示。
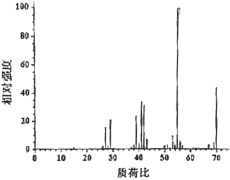
根据上述实验结果,C的分子式为___;
(5)取少量产物C进行核磁共振氢谱试验,共有三个信号峰。三个信号峰的面积之比为3:6:1。综合上述实验结果,C的结构简式为___;
(6)反应结束后,圆底烧瓶内液体分为两层。可用___方法(填实验操作名称)将两液体分离;
(7)后续检验证实,两液体均较纯净,其中所含杂质均可忽略。上层液体质量为10.7g。取下层液体进行核磁共振氢谱实验,共有两个信号峰。峰的面积之比为3:2。综合以上信息,本实验的实际总反应方程式为___。