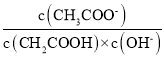��Ŀ����
����Ŀ����ҵ�Ͽ�����CO2���Ʊ����Һ�����ϼ״����йػ�ѧ��Ӧ���£�
��Ӧ��CO2��g��+3H2��g��CH3OH��g��+H2O��g�� ��H1����49.6kJmol-1
��Ӧ��CO2��g��+H2��g��H2O��g��+CO��g�� ��H2��+41kJmol-1
��1����Ӧ����___�������������������������¿��Է���Ӧ��
��2�����������������Ӧ�״�ƽ����ʵ�������___��
A�����¸�ѹ B�����µ�ѹ C�����µ�ѹ D�����¸�ѹ
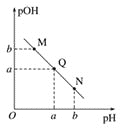
��3����Cu��ZnO/ZrO2���£�CO2��H2������壬�����1��3�������ʵ���amol���з�Ӧ�����CO2ת���ʡ�CH3OH��COѡ�������¶ȡ�ѹǿ�仯����ֱ���ͼ��ʾ��ѡ���ԣ�ת����CO2������CH3OH��CO�İٷֱȣ���

������˵����ȷ����___��
A��ѹǿ��Ӱ������ѡ����
B��CO2ƽ��ת�������¶�������������С
C����ͼ1��֪����Ӧ������¶�Ϊ220������
D����ʱ������״���ˮ�Լ�ʹ�����Ͷ�����̼ѭ��ʹ�ã������ԭ��������
��250��ʱ����Ӧ��͢�ﵽƽ�⣬ƽ��ʱ�������ΪVL��CO2ת����Ϊ25%��CH3OH��COѡ���Ծ�Ϊ50%������¶��·�Ӧ���ƽ�ⳣ��Ϊ___��
�۷���ͼ2��COѡ�����½���ԭ��___��
���𰸡����� D ACD ![]() ����ѹǿ�������ڷ�Ӧ��ƽ�������ƶ���ʹ��Ӧ��Ũ�ȼ�С���Ӷ�ʹ��Ӧ�������ƶ���COѡ�����½�
����ѹǿ�������ڷ�Ӧ��ƽ�������ƶ���ʹ��Ӧ��Ũ�ȼ�С���Ӷ�ʹ��Ӧ�������ƶ���COѡ�����½�
��������
���ݼ���˹�������жϷ�Ӧ�Է����е�����������ƽ���ƶ�ԭ��������𣻸���ת���ʡ�ƽ�ⳣ���ı���ʽ�������
��1�����ڷ�ӦCO2��g��+3H2��g��CH3OH��g��+H2O��g����H1=��49.6kJmol��1����H��0����S��0�����練Ӧ���Է����У�Ӧ�����H��T��S��0�������¼��ɽ��У��ʴ�Ϊ�����£�
��2����ӦCO2��g��+3H2��g��CH3OH��g��+H2O��g����H1=��49.6kJmol��1���ɻ�ѧ��������֪������ѹǿ��ƽ�������ƶ���������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�������¸�ѹ��������״��IJ��ʣ��ʴ�Ϊ��D��
��3����A.����ѹǿ����Ӧ�������ƶ����״��IJ�������˵��ѹǿӰ������ѡ���ԣ���A��ȷ��
B.��Ӧ��Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���������̼��ƽ��ת���ʼ�С����B����
C.��ͼ1��֪����Ӧ���¶ȿ�����220������ʱ��������̼��ת���ʡ��״��ĺ����ϴ�CO�ĺ�����С�����ߵ�240���Ժ״���ѡ���Լ�С����Ӧ������¶�Ϊ220�����ң���C��ȷ��
D.��ʱ������״���ˮ����ʹƽ�������ƶ�����ѭ��ʹ�������Ͷ�����̼�����ṩԭ�ϵ������ʣ���D��ȷ���ʴ�Ϊ��ACD��
����Cu��ZnO/ZrO2���£�CO2��H2������壬�����1��3�������ʵ���amol���з�Ӧ��
250��ʱ����Ӧ��͢�ﵽƽ�⣬ƽ��ʱ�������ΪVL��CO2ת����Ϊ25%��CH3OH��COѡ���Ծ�Ϊ50%���ɷ���ʽ��֪������n��CO2��=![]() ��25%mol=
��25%mol=![]() mol������CH3OH��CO��
mol������CH3OH��CO��![]() mol���ֱ�Ϊ
mol���ֱ�Ϊ![]() mol������n��H2O��=
mol������n��H2O��=![]() mol��������Ӧ�������������ʵ���Ϊ
mol��������Ӧ�������������ʵ���Ϊ![]() mol��3+
mol��3+![]() mol=
mol=![]() mol����ʣ�����������ʵ���Ϊ
mol����ʣ�����������ʵ���Ϊ![]() mol��
mol��![]() mol=
mol=![]() mol��
mol��![]() ����Ӧ���ƽ�ⳣ��
����Ӧ���ƽ�ⳣ��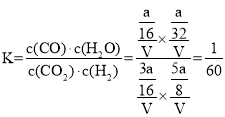 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
�۶��ڷ�Ӧ������ѹǿƽ�ⲻ�ƶ�������Ӧ��Ӧ������ѹǿ��ƽ�������ƶ������·�Ӧ���Ũ�Ƚ��ͣ�����ˮ��Ũ���������·�Ӧ��ƽ�������ƶ���CO��ѡ�����½����ʴ�Ϊ������ѹǿ�������ڷ�Ӧ��ƽ�������ƶ���ʹ��Ӧ��Ũ�ȼ�С���Ӷ�ʹ��Ӧ�������ƶ���COѡ�����½���

����Ŀ��ʵ�����Ʊ��������ԭ��Ϊ��3![]() +8KMnO4�T3KOOC��CH2��4COOK+8MnO2��+2KOH+5H2O
+8KMnO4�T3KOOC��CH2��4COOK+8MnO2��+2KOH+5H2O
��Ҫʵ��װ�úͲ������£�
������ͼװ���м���5mL10%����������Һ��50mLˮ������ʹ���ܽ⣬Ȼ�����6.3g������أ�С��Ԥ����Һ��40�档
�ڴӺ�ѹ©���л����μ�1.4mL�����������Ƶ��٣�ʹ��Ӧ�¶�ά����45�����ң���Ӧ20min�����ڷ�ˮԡ�ϼ���5min��ʹ��Ӧ��ȫ��ʹMnO2�������ۡ�
�ۼ����������������ƹ����ȥ���������ء�
��ͨ��___�������õ���������Һ��ϴ�ӳ���2��3�Σ���ϴ��Һ�ϲ�����Һ��
�ݼ���Ũ��ʹ��Һ���������10mL���ң�����С�ļ���Ũ���ᣬʹ��Һ��ǿ���ԣ�����pH��1��2������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ü������ɫ����1.5g��
��֪��������ĵ���ƽ�ⳣ����Ka1��3.8��10��5��Ka2��3.9��10-6����Է�������Ϊ146������ˮ���ܽ�����±�
�¶ȣ��棩 | 15 | 34 | 50 | 70 | 87 | 100 |
�������ܽ�ȣ�g�� | 1.44 | 3.08 | 8.46 | 34.1 | 94.8 | 100 |
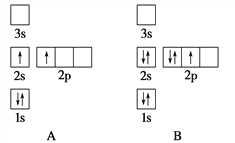
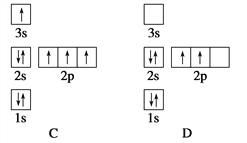
��1��������л����μӻ�������ԭ����___��
��2������ܻ��߲��ֲ�����___���ڵڢܡ��ݲ��о�Ҫ��ϴ�ӳ���������ϴ��Һ����Ϊ___��___��
��3������ݼ���Ũ�������pH��ǿ���Ե�ԭ����___��
��4���������Ʒ�Ĵ��ȿ������ζ����ⶨ��ȡ������ag��ȷ��0.0001g��������250mL��ƿ�У�����50mL��ȥCO2��������ˮ��ҡ��ʹ������ȫ�ܽ⣬��ȴ�����£��μ�3�η�̪��Һ����0.1000molL-1��NaOH����Һ�ζ�����ɫ��Ϊ�յ㣬����NaOH����Һ���bmL
������˵����ȷ����___��
A����ȡ��������Ʒ����ʱ���Ƚ���ƿ���ڵ�����ƽ���̵����룬��ʾ�����ȶ�����ȥƤ����������������ٻ�������Ʒ��������Ʒ������ʱ����¼��ȡ��Ʒ������
B��ҡƿʱ��Ӧ����ؽڣ�ʹ��Һ��һ��������Բ���˶���������ʹƿ�ڽӴ��ζ��ܣ���ҺҲ���ý���
C���ζ�ʱ�������ἷѹ��������Һ�����г���״����
D���ζ���������ͣ1��2���ӣ��ȴ��ζ����ڱڹ��е���Һ��ȫ����ʱ�ٶ�ȡ�̶���
E����¼�ⶨ���ʱ���ζ�ǰ���ӿ̶��ߣ��ζ������յ�ʱ�ָ��ӿ̶��ߣ������µζ����ƫ��
�ڼ��㼺���ᴿ�ȵı���ʽΪ___��