题目内容
【题目】常温下,向20mL0.05molL-1的某稀酸H2B溶液中滴入0.1molL-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是
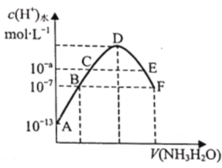
A.NaHB溶液中一定含有H2B分子
B.A、B、C三点溶液的pH逐渐减小,D、E、F三点溶液的pH逐渐增大
C.E溶液中离子浓度大小关系为c(NH4+)>c(B2-)>c(H+)>c(OH-)
D.B点溶液pH=7
【答案】C
【解析】
常温下,由图可知,0.05molL-1的某稀酸H2B溶液中由水电离产生的氢离子为10-13 molL-1,则H2B为二元强酸;向20mL0.05molL-1的某稀酸H2B溶液中滴入0.1molL-1氨水,溶液开始时为酸性,到D点时,二者恰好完全反应生成(NH4)2B,则溶液为酸性,至F点时,溶液为中性。
A.由分析可知,H2B为二元强酸,则NaHB溶液中不含有H2B分子,故A错误;
B.随着氨水的加入,溶液的酸性减弱,溶液的pH增大,所以A、B、C三点溶液的pH是逐渐增大的,故B错误;
C.E溶液显示酸性,硫酸铵和氨水的混合物,得到的溶液中铵根离子的水解程度较强,即c(H+)>c(OH-),所以c(NH4+)>c(B2-)>c(H+)>c(OH-),故C正确;
D.F点溶液的pH=7,B点溶液的pH<7,故D错误;
综上所述,答案为C。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目