题目内容
【题目】氮元素可以形成多种物质,根据已学的知识,回答下列问题:
(1)氮原子的核外电子排布式是___________,其最外层电子有_____种不同的运动状态。
(2)氮气在常温常压下是很稳定的,对此的合理解释是____________________。
(3)N元素处于同一主族的P、As元素,这三种元素形成的气态氢化物的稳定性由大到小的顺序是________________________。
(4)工业上常用氮气与氢气来合成氨气,温度控制在400~500 ℃,采用铁触媒做催化剂,压强控制在2 ⅹ 105 ~ 5 ⅹ 105 Pa。
①该反应的化学方程式为_____________________。
它的平衡常数表达式为_______________________。
②在一体积为10 L的密闭容器中充入了280 g N2,100 g H2,反应半小时后,测得有34 g NH3生成,则用H2表示该反应的速率为_________mol/(Lmin)。此时,氮气的转化率为__________。
③下列判断可以作为该反应达到平衡的标志的是(_______)
A.单位时间内每消耗1摩尔氮气的同时消耗3摩尔氢气
B.混合气体的平均分子量不再发生变化
C.混合气体的密度保持不变
D.体系的温度不再变化
④当反应达到平衡后的t2时刻,将混合气体通过“分子筛”,可以及时将产物NH3分理出平衡体系,这会使得平衡正向移动,请根据平衡移动原理,在下图中画出t2时刻后平衡移动的示意图:_____________

⑤当及时分离出氨气后,工业上常常将氮气、氢气再次转移到反应器,这样做的原因是________________。
⑥氨气常用来生产化肥NH4Cl,NH4Cl溶于水会使得溶液显__________性,在该盐的水溶液中存在多种微粒:NH4+、NH3H2O、H+、Ci-,这些离子浓度由大到小的顺序为_________;该盐溶液中还存在多种守恒,请任意写出一种合理的守恒关系式___________________。
⑦工业上常用氨气来制备硝酸,其中第1步是用氨气与纯氧在Cr2O3的催化作用下制得NO和水。请写出这个反应的化学方程式并配平______________________。该反应中,还原剂是_________________,若反应中转移了1.204 ⅹ 1024 个电子,则生成的 NO在标准状况下的体积是________L。
【答案】 1s22s22p3 5 氮气分子中存在叁健 NH3 > PH3 > AsH3 N2 + 3H2 = 2NH3 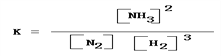 0.01 mol/(Lmin) 10% BD
0.01 mol/(Lmin) 10% BD 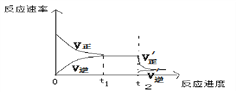 提高原料N2、H2的利用率,降低生产成本 酸性 [ Cl-] 〉[NH4+] 〉[H+] 〉[NH3H2O] [H+] + [NH4+] = [OH-] + [Cl-] 或 [Cl-] = [NH3H2O]+ [NH4+]或 [H+] = [OH-] + [NH3H2O] 4 NH3 + 5O2
提高原料N2、H2的利用率,降低生产成本 酸性 [ Cl-] 〉[NH4+] 〉[H+] 〉[NH3H2O] [H+] + [NH4+] = [OH-] + [Cl-] 或 [Cl-] = [NH3H2O]+ [NH4+]或 [H+] = [OH-] + [NH3H2O] 4 NH3 + 5O2 ![]() 4NO + 6H2O NH3 8.96 L
4NO + 6H2O NH3 8.96 L
【解析】(1)氮元素的核电荷数为7,基态氮原子的核外电子排布式是 1s22s22p3,其最外层电子数为5,有5种不同的运动状态;
(2)氮气分子中存在叁健,导致氮气在常温常压下化学性质很稳定;
(3)非金属性越强形成的气态氢化物的稳定性越强,N、P、As元素的非金属性随核电荷数增大而减小,则三种元素形成的气态氢化物的稳定性由大到小的顺序是NH3>PH3>AsH3 ;
(4) ①合成氨反应的化学方程式为N2 + 3H2 ![]() 2NH3;此反应的平衡常数表达式为
2NH3;此反应的平衡常数表达式为![]() ;
;
②在一体积为10 L的密闭容器中充入![]() =10molN2,
=10molN2, ![]() =50molH2,反应半小时后,测得有
=50molH2,反应半小时后,测得有![]() =2molNH3生成,则用H2表示该反应的速率为
=2molNH3生成,则用H2表示该反应的速率为![]() ×
×![]() mol/(Lmin)=0.01 mol/(Lmin);此时,氮气的转化率为
mol/(Lmin)=0.01 mol/(Lmin);此时,氮气的转化率为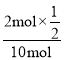 ×100%=10%;
×100%=10%;
③A.单位时间内每消耗1摩尔氮气的同时消耗3摩尔氢气,均为正反应速率,无法判断是平衡状态,故A错误;B.混合气体的质量始终不变,混合气体的总物质的量是不定值,混合气体的平均分子量不再发生变化,说明反应达到平衡,故B正确;C.混合气体的质量和体积始终不变,密度保持不变,无法说明是平衡状态,故C错误;D.体系的温度不再变化,说明反应处于相对静止状态,是平衡状态,故D正确;答案为BD;
④平衡后将NH3分离出平衡体系,即减小生成物的浓度,逆反应速率瞬间减小,正反应速率瞬间不变,平衡正向移动,重新形成新的平衡状态,t2时刻后平衡移动的示意图为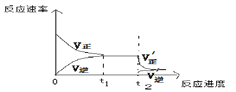 ;
;
⑤将反应后的氮气、氢气再次转移到反应器,这样做提高原料N2、H2的利用率,降低生产成本;
⑥NH4Cl溶于水,NH4+的水解会使得溶液显酸性,在该盐的水溶液中存在多种微粒:NH4+、NH3H2O、H+、Cl-,其中NH3H2O是水解产物,H+来源于水和NH4+的水解,
则离子浓度由大到小的顺序为[ Cl-] 〉[NH4+] 〉[H+] 〉[NH
⑦氨气与纯氧在Cr2O3的催化作用下制得NO和水,根据电子守恒及原子守恒得此反应的化学方程式4 NH3 + 5O2 ![]() 4NO + 6H2O,该反应中,氨气中氮元素化合价升高,发生氧化反应,氨气是还原剂,若反应中转移了1.204×1024个电子,即转移2mol电子,参加反应的NH3的物质的量为
4NO + 6H2O,该反应中,氨气中氮元素化合价升高,发生氧化反应,氨气是还原剂,若反应中转移了1.204×1024个电子,即转移2mol电子,参加反应的NH3的物质的量为![]() =0.4mol,生成NO的物质的量为0.4mol, NO在标准状况下的体积是0.4mol×22.4L/mol=8.96L。
=0.4mol,生成NO的物质的量为0.4mol, NO在标准状况下的体积是0.4mol×22.4L/mol=8.96L。