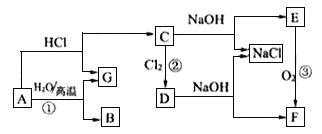
题目内容
【题目】把Na2O2投入FeCl2溶液中,可观察到的现象是( )
A.生成白色沉淀
B.生成红褐色沉淀
C.无气泡产生
D.无变化
【答案】B
【解析】解:将Na2O2投入FeCl2溶液中,发生的反应为:2Na2O2+2H2O=4NaOH+O2↑,2NaOH+FeCl2=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+H2O=4Fe(OH)3 , 4Fe(OH)2是白色沉淀易被氧化为红褐色的Fe(OH)3沉淀,所以看到的现象是:有大量气泡生成,出现白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色.故选:B.

练习册系列答案
相关题目