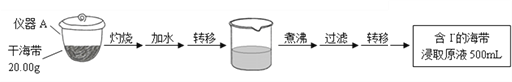
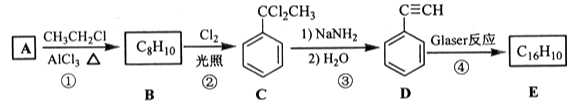
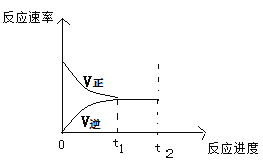
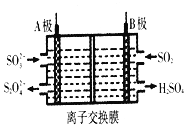
题目内容
【题目】下列说法正确的是
A. 按分散剂种类可将分散系分为溶液、胶体和浊液
B. 水玻璃、碘水、Fe(OH)3胶体均为混合物
C. CO2、SO3、CO均属于酸性氧化物
D. KNO3溶液、Cu、熔融的NaCl均能导电,所以它们都属于电解质
【答案】B
【解析】A、当分散剂是水或其他液体时,根据分散质粒子大小,可以把分散系分为溶液、胶体、浊液,故A错误;B、水玻璃、碘水、Fe(OH)3胶体都由多种物质组成,属于混合物,故B正确;C、CO不能和碱或酸反应生成盐和水,不属于酸性氧化物,属于不成盐氧化物,故C错误;D、铜是单质,不是电解质,也不属于非电解质,故D错误;故选B。

练习册系列答案
相关题目