题目内容
(1)在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8(连二硫酸铵)溶液会发生如下离子反应(未配平):
Mn2++S2O82—+H2O→MnO4—+SO42—+H+;
①该反应常用于检验Mn2+的存在,其特征现象是___________________________________。
②若反应中有0.1 mol还原剂参加反应,则转移电子数为________NA,消耗氧化剂的物质的量______________mol。
③写出该反应的离子方程式_________________________________。
(2)①向CuSO4溶液中通入硫化氢生成黑色沉淀CuS的离子方程式为___________________________________;
②向FeCl3溶液中加入过量的碘化钠溶液的离子方程式为_____________。
(3)在碱性介质中,H2O2有较强的还原性,可与Ag2O反应,该反应中氧化剂与还原剂的物质的量之比为___________________。
(4)为测定大气中的臭氧(O3)含量,将0℃、1.01×105 Pa的空气V L慢慢通入足量KI溶液,使臭氧完全反应;然后将所得溶液用a mL c mol·L-1的Na2S2O3溶液进行滴定,恰好达到终点。已知:2Na2S2O3+I2=Na2S4O6+2NaI。
①该滴定过程中可选择的指示剂为________。
②O3与KI溶液反应生成两种单质,则反应的化学方程式为___________________________。
③空气中臭氧的体积分数为________(用含“a、c、V”的字母表示)。
Mn2++S2O82—+H2O→MnO4—+SO42—+H+;
①该反应常用于检验Mn2+的存在,其特征现象是___________________________________。
②若反应中有0.1 mol还原剂参加反应,则转移电子数为________NA,消耗氧化剂的物质的量______________mol。
③写出该反应的离子方程式_________________________________。
(2)①向CuSO4溶液中通入硫化氢生成黑色沉淀CuS的离子方程式为___________________________________;
②向FeCl3溶液中加入过量的碘化钠溶液的离子方程式为_____________。
(3)在碱性介质中,H2O2有较强的还原性,可与Ag2O反应,该反应中氧化剂与还原剂的物质的量之比为___________________。
(4)为测定大气中的臭氧(O3)含量,将0℃、1.01×105 Pa的空气V L慢慢通入足量KI溶液,使臭氧完全反应;然后将所得溶液用a mL c mol·L-1的Na2S2O3溶液进行滴定,恰好达到终点。已知:2Na2S2O3+I2=Na2S4O6+2NaI。
①该滴定过程中可选择的指示剂为________。
②O3与KI溶液反应生成两种单质,则反应的化学方程式为___________________________。
③空气中臭氧的体积分数为________(用含“a、c、V”的字母表示)。
(1)①溶液变成紫色 ②0.5 0.25
③2Mn2++5S2O82—+8H2O=2MnO4—+10SO42—+16H+
(2)①Cu2++H2S=CuS↓+2H+
②2Fe3++2I-=2Fe2++I2
(3)1∶1
(4)①淀粉溶液
②2KI+O3+H2O=2KOH+O2+I2
③0.0112ac/V
③2Mn2++5S2O82—+8H2O=2MnO4—+10SO42—+16H+
(2)①Cu2++H2S=CuS↓+2H+
②2Fe3++2I-=2Fe2++I2
(3)1∶1
(4)①淀粉溶液
②2KI+O3+H2O=2KOH+O2+I2
③0.0112ac/V
(1)②首先标化合价,Mn元素化合价由+2升高到+7,S元素化合价由+7降低到+6,所以1 mol还原剂(Mn2+)失去5 mol电子,1 mol氧化剂(S2O82—)得到2 mol电子,0.1 mol Mn2+参加反应转移0.5 mol电子,依据得、失电子守恒,消耗n(S2O82—)=0.5/2 mol
③利用化合价升降法配平
(2)①由产物可知化合价没有变化是复分解反应,溶液中的Cu2+与H2S提供的S2-反应生成CuS沉淀,注意H2S是弱电解质;②Fe3+具有氧化性,I-具有还原性。
(3)1 mol H2O2被氧化成氧气,失去2 mol电子,1 mol Ag2O被还原为Ag,得到2 mol电子,故氧化剂与还原剂的物质的量之比为1∶1。
(4)O3将I-氧化成I2,I2和Na2S2O3反应,利用淀粉溶液作指示剂,终点现象为蓝色变为无色。由O3~I2~2Na2S2O3,可计算出臭氧的体积分数。
③利用化合价升降法配平
(2)①由产物可知化合价没有变化是复分解反应,溶液中的Cu2+与H2S提供的S2-反应生成CuS沉淀,注意H2S是弱电解质;②Fe3+具有氧化性,I-具有还原性。
(3)1 mol H2O2被氧化成氧气,失去2 mol电子,1 mol Ag2O被还原为Ag,得到2 mol电子,故氧化剂与还原剂的物质的量之比为1∶1。
(4)O3将I-氧化成I2,I2和Na2S2O3反应,利用淀粉溶液作指示剂,终点现象为蓝色变为无色。由O3~I2~2Na2S2O3,可计算出臭氧的体积分数。

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案
相关题目


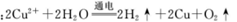

 )+c(OH-)
)+c(OH-)
 2Na+ +2OH-+H2↑+Cl2↑
2Na+ +2OH-+H2↑+Cl2↑  H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH- CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O