题目内容
【题目】合成氨工业在国民生产中有重要意义。回答下列问题:
(1)在恒温恒压条件下,在装置中发生合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) ,下列说法正确的是(______)(填字母)
2NH3(g) ,下列说法正确的是(______)(填字母)
A.气体体积不再变化,则已经平衡
B.气体密度不再变化,可能尚未达到平衡
C.平衡后,向装置中通入氩气,压强不变,平衡不移动
D.平衡后,压缩体积,则生成更多的氨气
E.催化剂可以提高生产氨气的产率
(2)N2(g)+3H2(g)![]() 2NH3(g) ΔH = —92.0 kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图1所示。
2NH3(g) ΔH = —92.0 kJ·mol-1,恒容时,体系中各物质浓度随时间变化曲线如图1所示。
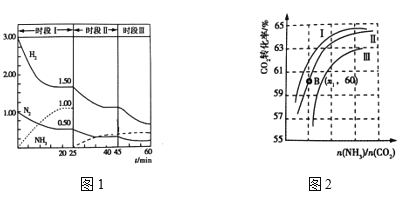
①25min时采取的措施是 _______________________________ 。
②三个时间段分别是改变一个条件引起的平衡移动,平衡时平衡常数KⅠ、KⅡ、KⅢ的大小关系 __________________。
③在实际工业生产中和①中措施的目的相同的其他措施还有 _____________________(写两条)
(3)①合成氨工艺生产中间环节产生的CO会导致催化剂中毒,常用铜液[醋酸二氨合铜(Ⅰ)、氨水]吸收,Cu(NH3)2Ac + CO + NH3 ![]() [Cu(NH3)3CO]Ac ΔH<0。简述吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________________________________________________________________
[Cu(NH3)3CO]Ac ΔH<0。简述吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________________________________________________________________
②如果要提高上述反应的反应速率,且提高氨气的转化率,可采取的措施有(______)
a. 加压 b.加催化剂 c.升温 d.及时移走产物
(4)①用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g) ΔH<0。已知该反应的v (正)=k(正)c2(NH3)c(CO2),v (逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正)、k(逆)的关系式是__________________
CO(NH2)2(l)+H2O(g) ΔH<0。已知该反应的v (正)=k(正)c2(NH3)c(CO2),v (逆)=k(逆)c(H2O),k(正)和k(逆)为速率常数,则平衡常数K与k(正)、k(逆)的关系式是__________________
②实际生产中,原料气带有水蒸气,图2表示CO2转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。
的变化关系。
a. 曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比![]() 最大的是_______________。
最大的是_______________。
b.测得B点氨的转化率为40%,则X1= _________________ 。
【答案】AD将N2从反应体系中分离出去KⅢ >KⅠ=KⅡ高压、原料气循环利用低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用aK=k(正)/k(逆)Ⅲ3
【解析】
(1)A.恒温恒压下,气体摩尔体积相同,由于n=V/Vm,则气体体积不再变化,就是气体的总物质的量不再变化,说明反应已达平衡,故A正确;
B.气体密度等于气体质量除以气体总体积,根据质量守恒定律可知气体质量始终不变,若气体密度不再变化,则气体总体积不变,即气体的总物质的量不变,说明反应已达平衡,故B错误;
C.平衡后充入稀有气体,维持恒温恒压,必须增大容器容积,其实质是减小压强,平衡向逆反应方向移动,故C错误;
D.平衡后,压缩装置,缩小容器容积,其实质是增大压强,平衡向正反应方向移动,故D正确;
E.催化剂不能使平衡发生移动,只能加快反应速率,缩短到达平衡的时间,故不能提高生产氨气的产率,故E错误。
因此,本题正确答案是:AD;
(2)①25 min时氨气的物质的量迅速变为0,而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25 min时改变的条件是将NH3从反应体系中分离出去;
②根据以上分析,25 min时改变的条件是将NH3从反应体系中分离出去,45 min时改变的条件时,氮气、氢气和氨气浓度都没变,之后氮气和氢气减小,氨气增加,说明平衡正向移动,平衡常数增大,是降低温度的结果,由于平衡常数只与温度有关,所以平衡常数KⅢ >KⅠ=KⅡ;
③在实际工业生产中和①中措施的目的相同的其他措施还有高压、原料气循环利用等;
因此,本题正确答案是:将N2从反应体系中分离出去;KⅢ >KⅠ=KⅡ;高压、原料气循环利用;
(3)①吸收CO后的乙酸铜氨溶液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,依据Cu(NH3)2Ac + CO + NH3 ![]() [Cu(NH3)3CO]Ac ΔH<0,是气体体积减小的放热反应,可知再生的适宜条件是高温低压;
[Cu(NH3)3CO]Ac ΔH<0,是气体体积减小的放热反应,可知再生的适宜条件是高温低压;
②如果要提高上述反应的反应速率,且提高氨气的转化率,可采取的措施是加压,故选a,
因此,本题正确答案是:低温加压下吸收CO,然后将铜洗液转移至另一容器中,高温低压下释放CO,然后将铜洗液循环利用;a;
(4)①2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g),已知该反应的v (正)=k(正)c2(NH3)c(CO2),v (逆)=k(逆)c(H2O),平衡时,v (正)= v (逆),则k(正)c2(NH3)c(CO2)= k(逆)c(H2O),k(正)/ k(逆)= c(H2O)/ c2(NH3)c(CO2)=K,
CO(NH2)2(l)+H2O(g),已知该反应的v (正)=k(正)c2(NH3)c(CO2),v (逆)=k(逆)c(H2O),平衡时,v (正)= v (逆),则k(正)c2(NH3)c(CO2)= k(逆)c(H2O),k(正)/ k(逆)= c(H2O)/ c2(NH3)c(CO2)=K,
②a.氨碳比相同时曲线Ⅰ对应二氧化碳的转化率大,相应的水碳比较小,所以曲线Ⅲ对应的水碳比最大;
b.由题意可知:
2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)
CO(NH2)2(l)+H2O(g)
起始量 x1 1
变化量 2a a
即![]() 100%=40%,
100%=40%,![]() 100%=60%,则x1=3。
100%=60%,则x1=3。
因此,本题正确答案是:K=k(正)/k(逆) ;Ⅲ; 3。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】十九大报告提出要“打赢蓝天保卫战”,意味对环境污染防治比过去要求更高。
(1)烟气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) H < 0 平衡常数K1
NaNO3(s)+ClNO(g) H < 0 平衡常数K1
2NO(g)+Cl2(g)![]() 2ClNO(g) H < 0 平衡常数K2
2ClNO(g) H < 0 平衡常数K2
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)利用CO可将NO转化为无害的N2,其反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
在容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入物质的量之比为1:1的NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min n(CO) /mol | 0 | 40 | 80 | 120 | 160 |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
① 甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
② T ___ 300℃,该反应的△H______0(填“>”或“<”)。
③ 甲容器达平衡时α(NO)=_______。
丙容器达平衡时c(NO)可能为________0.4mol/L(填“>”、“=”或“<”)。
④ 已知甲容器CO的体积分数![]() (CO)随时间t的变化如图,画出其他条件不变,绝热条件下,
(CO)随时间t的变化如图,画出其他条件不变,绝热条件下, ![]() (CO)随时间t的变化示意图。_____________________
(CO)随时间t的变化示意图。_____________________

(3)处理含镉废水常用化学沉淀法。以下是几种镉的难溶化合物25℃时的溶度积常数: Ksp(CdCO3)=5.2×10-12 Ksp(CdS)=3.6×10-29 Ksp(Cd(OH)2)=2.0×10-16,
回答下列问题:
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。沉淀Cd2+效果最佳的试剂是____________
a.Na2CO3 b.Na2S c.CaO