题目内容
1.在某一化学反应,0.5L的密闭容器中,反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为( )| A. | 3 mol•L-1 | B. | 0.3mol•L-1•s-1 | C. | 0.6mol•L-1•s-1 | D. | 0.1mol•L-1•s-1 |
分析 反应速率表示单位时间内浓度的变化量,即反应速率v=$\frac{△c}{△t}$,据此计算.
解答 解:反应速率表示单位时间内浓度的变化量,则5s内B的化学反应速率=$\frac{△c}{△t}$=$\frac{2.0mol-0.5mol}{0.5L•5s}$=0.6mol/L•s,
故选C.
点评 本题考查反应速率的计算,根据反应速率公式进行计算,注意纯液体、固体浓度一般认为是常数,其浓度在反应中不变.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
11.下列实验操作或装置正确的是( )
| A. | 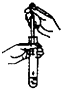 向试管中滴加液体 | B. | 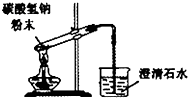 碳酸氢钠受热分解 | ||
| C. | 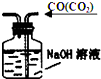 除去CO气体中的CO2气体 | D. | 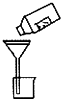 过滤 |
12.既可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的乙烯的方法是( )
| A. | 通入足量溴水中 | B. | 在空气中燃烧 | ||
| C. | 通入饱和食盐水中 | D. | 通入澄清石灰水 |
9.在下列反应中,硫元素表现出氧化性的是( )
| A. | 二氧化硫与氧气反应 | B. | 三氧化硫与水反应 | ||
| C. | 稀硫酸与镁反应 | D. | 浓硫酸与碳反应 |
16.下列各组微粒具有相同的质子数和电子数的是( )
| A. | OH-、H2O、F- | B. | Na+、NH4+、H3O+ | C. | H3O+、NH4+、NH2- | D. | Cl-、K+、H2S |
6.下列反应,能用离子方程式S2-+2H+→H2S↑来表示的是( )
| A. | FeS+HCl | B. | K2S+HCl | C. | Na2S+CH3COOH | D. | K2S+H2SO3 |
13.锌粒与稀盐酸反应,对锌粒的消耗速率进行计量时,下列单位中不能使用的是( )
| A. | mol/L•s | B. | mol/s | C. | mol/min | D. | g/s |
10.工业制硫酸中的一步重要反应是SO2在400~500℃的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法中错误的是( )
| A. | 使用催化剂可以加快反应速率,提高生产效率 | |
| B. | 适当提高O2的浓度可以提高SO2的转化率 | |
| C. | 达到平衡时,正反应速率和逆反应速率都为零 | |
| D. | 达到平衡时,SO2、O2、SO3的物质的量浓度不再变化 |
11.下列化学用语正确的是(( )
| A. | 质子数35、中子数45的溴原子:${\;}_{35}^{80}$Br | |
| B. | CH4的球棍模型示意图为 | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | H216O、D216O、H218O、D218O互为同位素 |