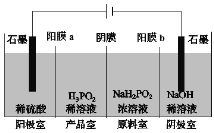
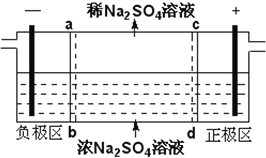
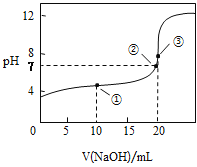
题目内容
【题目】25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是( )
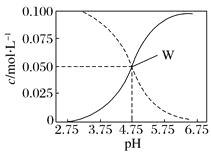
A. pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
C. 由W点可以求出25℃时CH3COOH的电离常数
D. pH=4的溶液中:c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1mol·L-1
【答案】A
【解析】
试题A.pH=5的溶液说明溶液显酸性,因此醋酸的电离程度大于醋酸根的水解程度,则溶液中
c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-),A错误;B.根据电荷守恒可知溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),B正确;C.W点对应的醋酸和醋酸根的浓度洗涤,根据pH可以计算氢离子的浓度,则根据醋酸的电离平衡常数表达式![]() 可知,由W点可以求出25°C时CH3COOH的电离常数,C正确;D.pH=4的溶液中根据电荷守恒可知溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-)。又因为c(CH3COOH)+c(CH3COO-)=0.1 mol/L,则溶液中c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol/L,D正确,答案选A。
可知,由W点可以求出25°C时CH3COOH的电离常数,C正确;D.pH=4的溶液中根据电荷守恒可知溶液中:c(H+)+c(Na+)=c(CH3COO-)+c(OH-)。又因为c(CH3COOH)+c(CH3COO-)=0.1 mol/L,则溶液中c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol/L,D正确,答案选A。

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目