题目内容
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9]。下列说法正确的是
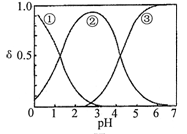

| A.曲线①代表的粒子是HC2O4- |
| B.0.1 mol·L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| C.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) |
| D.一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |
B
试题分析:A、H2C2O4、HC2O4-和C2O42-三种形态的粒子随pH值呈依次增大,故分别为①②③曲线,错误;B、由图知NaHC2O4溶液为酸性,所以在存在的水解平衡和电离平衡中以电离平衡为主,故c(C2O42-)>c(H2C2O4),正确;C、由图可知pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4),错误;D、加入少量CaCl2固体,沉淀溶解平衡逆向移动,c(C2O42-)将减小,但Ksp不变,故c(Ca2+)变大,错误。

练习册系列答案
相关题目
 的水解程度增大,故碱性增强,有关反应的离子方程式为__________________________。乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为______________________________。
的水解程度增大,故碱性增强,有关反应的离子方程式为__________________________。乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为______________________________。