题目内容
【题目】如图是甲醇燃料电池的构造示意图,该电池总反应式为:2CH3OH+3O2=2CO2+4H2O。下列有关该电池的说法不正确的是( )
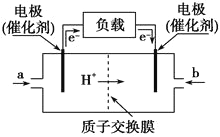
A.等量的甲醇通过燃料电池释放的电能比其通过火力发电产生的电能多
B.左边的电极为电池的负极,a处通入的是甲醇
C.电池负极的反应式为:2CH3OH+2H2O-12e-=2CO2↑+12H+
D.若用池电池电解足量饱和食盐水(石墨电极),消耗1mol甲醇时,产生标况下44.8L氢气
【答案】D
【解析】
试题分析:A.利用甲醇火力发电时化学能还要转化为光能且能量损失大,故A正确;B.依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,失电子发生氧化反应;所以a处是失电子的一端,通的是甲醇,故B正确;C.负极是甲醇失电子发生氧化反应,依据电池反应和酸性环境,2CH3OH+3O2=2CO2+4H2O,负极电极反应为:CH3OH+H2O-6e-=CO2+6H+,故C正确;D.若用池电池电解足量饱和食盐水(石墨电极),消耗1mol甲醇时,转移6mol电子,产生标况下33.6L氢气,故D错误;故选D。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目