题目内容
【题目】用AG表示溶液酸度:AG = lg![]() 。在室温下,用0.1 mol/L的HCl溶液滴定20.00mL0.1mol/L氨水。滴定结果可表示如下图: 下列分析正确的是
。在室温下,用0.1 mol/L的HCl溶液滴定20.00mL0.1mol/L氨水。滴定结果可表示如下图: 下列分析正确的是
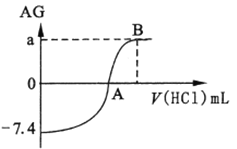
A. 0. lmol/L 氨水 pH = 10.2
B. A点加入盐酸的体积为20. 00mL
C. 若a=7,从A到B水的电离程度逐渐减小
D. B点溶液中可能存在c(Cl-)>c(NH4+ )>(H+)>c(OH-)
【答案】D
【解析】A、没有滴加盐酸时,AG=-7.4,即c(H+)/c(OH-)=10-7.4,利用水的离子积,计算出c(H+)=10-10.6mol·L-1,即pH=10.6,故A错误;B、A点对应AG=0,说明溶液显中性,因为NH3·H2O是弱碱,溶质为NH3·H2O和NH4Cl,因此所加盐酸的体积小于20.00mL,故B错误;C、当AG=7时,溶液显酸性,溶质可能是NH4Cl,NH4+水解,促进水的电离,水的电离程度增大,故C错误;D、根据选项C的分析,溶质为NH4Cl,NH4+发生水解,溶液显酸性,即c(Cl-)>c(NH4+ )>(H+)>c(OH-),故D正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目