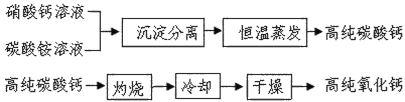
题目内容
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素的基态价电子排布式为_____________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______________,提供孤电子对的成键原子是_____________。
②氨的沸点_________(填“高于”或“低于”)膦(PH3),原因是__________________;氨是_________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______________键形成的晶体。
(4)某镍白铜合金的立方晶胞结构如图所示。
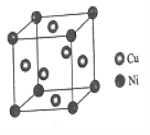
①晶胞中铜原子与镍原子的数量比为___________。
②若合金的密度为dg/cm3,晶胞边长a=______________nm。
【答案】3d84s2 2 配位键 N 高于 NH3分子间可形成氢键 极性 sp3 金属 3:1 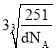 ×10-7
×10-7
【解析】
(1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写镍元素基态原子的电子;
(2)①含有孤电子对和含有空轨道的原子之间存在配位键,在[Ni(NH3)6]2+中Ni2+提供空轨道、NH3提供孤电子对,所以在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为配位键;
②有氢键的氢化物熔沸点较高,氨气中含有氢键、膦中不含氢键;
(3)金属晶体中存在金属键,则该物质中含有金属键;
(4)①该晶胞中Ni原子个数=8×![]() =1、Cu原子个数=6×
=1、Cu原子个数=6×![]() =3,则Cu、Ni原子个数之比为3:1;
=3,则Cu、Ni原子个数之比为3:1;
②该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,晶胞参数=3![]() ,以此解答。
,以此解答。
(1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;3d能级上的未成对的电子数为2,故答案为:1s22s22p63s23p63d84s2或[Ar]3d84s2;2;
(2)①含有孤电子对和含有空轨道的原子之间存在配位键,在[Ni(NH3)6]2+中Ni2+提供空轨道、NH3提供孤电子对,所以在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为配位键,提供孤电子对的成键原子是N,故答案为:配位键;N;
②有氢键的氢化物熔沸点较高,氨气中含有氢键、膦中不含氢键,则氨的熔沸点高于膦;氨气分子结构不对称,正负电荷重心不重合,所以为极性分子;氨气分子中中心原子N原子的价层电子对个数=3+![]() =4且含有一个孤电子对,根据价层电子对互斥理论判断N原子的轨道杂化类型为sp3,故答案为:高于;氨气分子间存在氢键;极性;sp3;
=4且含有一个孤电子对,根据价层电子对互斥理论判断N原子的轨道杂化类型为sp3,故答案为:高于;氨气分子间存在氢键;极性;sp3;
(3)金属晶体中存在金属键,则该物质中含有金属键,故答案为:金属;
(4)①该晶胞中Ni原子个数=8×![]() =1、Cu原子个数=6×
=1、Cu原子个数=6×![]() =3,则Cu、Ni原子个数之比为3:1,故答案为:3:1;
=3,则Cu、Ni原子个数之比为3:1,故答案为:3:1;
②该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,晶胞参数=3![]() =3
=3![]() cm=
cm=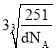 ×10-7nm,故答案为:
×10-7nm,故答案为: 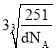 ×10-7。
×10-7。

 阅读快车系列答案
阅读快车系列答案【题目】铁及其化合物有重要且广泛的应用
(1)基态Fe2+的价层电子排布图为_____________
(2)检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下表:
元素 | Mn | Fe | |
电离能 |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
根据表中数据可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是___________________________。
(4)已知Fe单质有如图所示的两种常见堆积方式:
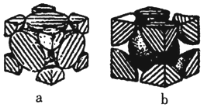
其中属于体心立方密堆积的是______填“a”或“b”;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
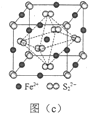
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3。
【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol/L的硫酸于试管中② | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为____________________
(2)甲同学的实验目的是:在相同的温度下,__________________________________。
实验二:乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。
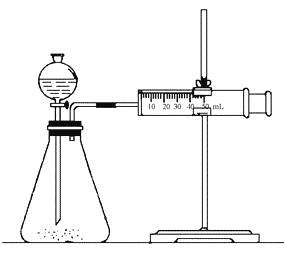
(3)乙同学在实验中应该测定的数据是______________。
(4)乙同学完成该实验应选用的实验药品是______________________;该实验中不选用某浓度的硫酸,理由是_________________________。