题目内容
【题目】W、X、Y和Z都是元素周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y的化合物;
②Y 和Z属同族元素,他们能形成两种常见化合物;
③X和Z属同一周期元素,他们能形成两种气态化合物;
④W和Z能形成组成为W2Z和W2Z2的化合物;
⑤X和Y不在同一周期,他们能形成组成为XY2的化合物。请回答:
(1)Y元素名称是___________;
(2)用一方程式证明Y与X非金属性的强弱__________,证明Y与Z非金属性的强弱_____________。
(3)标准状况22.4LXZ2和通过足量的W2Z2时,转移的电子数是____,W2Z2的质量将增加______g
(4)观察W元素的焰色的操作注意事项__________________________
(5)上述某元素形成的分子式为C8H10的属于苯的同系物的同分异构体有______________ 种。其中,苯环上的一氯代物种类最多的结构简式为_______________。
【答案】硫 H2SO4+Na2CO3=Na2SO4+H2O+CO2↑ O2+2H2S=2H2O+2S NA 28 隔着蓝色钴玻璃观察 4 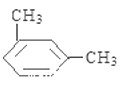
【解析】
W、X、Y和Z都是周期表中前20号元素,②Y和Z属同主族元素,它们能形成两种常见化合物,化合物为SO2、SO3,则分别为O、S元素中的一种,结合③中X和Z属同周期元素,它们能形成两种气态化合物,可推知X为C元素,Z为O元素,Y为S元素,⑤X和Y不在同一周期,它们能形成组成CS2,由①W的阳离子Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y的化合物,则W为K,化合物W2Y为K2S;④W和Z能形成组成为K2O和K2O2的化合物,据此解答。
(1)由上述分析可知,Y为硫元素,
故答案为:硫;
(2)由上述分析可知,Y为硫元素,X为碳元素,Z为氧元素,元素的非金属性越强,最高价氧化物水化物的酸性越强,能证明硫酸的酸性强于碳酸,则证明硫的非金属性比碳强,化学方程式为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;元素的非金属性越强氢化物还原性越强,能证明还原性H2S大于H2O,则证明氧的非金属性强于硫,化学方程式为:O2+2H2S=2H2O+ 2S,
故答案为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;O2+2H2S=2H2O+ 2S;
(3)标准状况22.4LCO2为1mol,反应2CO2+2K2O2=2K2CO3+O2中,K2O2既作氧化剂又作还原剂,部分K2O2中氧元素从-1价升高到0价,每生成1molO2转移2mol电子,则有1mol CO2反应时生成0.5mol O2转移1mol电子,转移的电子数是NA;根据质量守恒定律,K2O2的质量增加等于气体质量的减小,44g-32g![]() =28g,
=28g,
故答案为:NA ;28;
(4))由上述分析可知,W为钾元素,观察钾元素的焰色隔着蓝色钴玻璃观察,滤去钠元素的黄光,
故答案为:隔着蓝色钴玻璃观察;
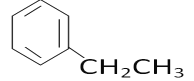
(5)C8H10的属于苯的同系物的同分异构体有乙苯、邻二甲苯、间二甲苯和对二甲苯共4种,苯环上的一氯代物分别有3种、2种、3种和1种,种类最多的是乙苯、间二甲苯,结构简式为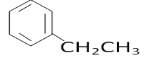 、
、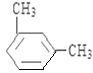 ,
,
故答案为:4; 、
、 。
。

 天天向上口算本系列答案
天天向上口算本系列答案