题目内容
【题目】(1)实验室常用A的饱和溶液制备微粒直径为1nm-l00nm的红褐色液相分散系.则该反应的化学方程式为:________________,将A 的溶液加热蒸干并灼烧,得到固体的化学式为:_____________。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL,6mol/L的B溶液中逐滴滴入100ml 某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为________________。
(3)将A、B中两种金属元素的单质用导线连接,插入一个盛有KOH溶液的烧杯中构成原电池,则负极发生的电极反应为:________________________。
(4)C、D、E均是短周期中同一周期元素形成的单质或化合物,常温下D为固体单质,C和E均为气态化合物,且可发生反应:C+D![]() E.则:
E.则:
①写出C 的电子式:________________。
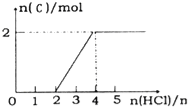
②将一定量的气体C通入某浓度的KOH溶液得溶液F,向F溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(C)的关系如图所示,则生成F 的离子方程式________________,F 中离子浓度由大到小的顺序为___________。
【答案】(1)FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl(2)3mol/L或11mol/L(2 分)
Fe(OH)3(胶体)+3HCl(2)3mol/L或11mol/L(2 分)
(3)Al- 3e-+4OH-=AlO2一+2H2O(2分)(4)①CO2的电子式![]() (2分)
(2分)
② CO2+2OH—=CO32—+H2O(2分)c(K+)>c(CO32一)>c(OH一)>c(HCO3一)>c(H+)(3分)
【解析】试题分析:(1)由题意知该分散系为Fe(OH)3(胶体),Fe(OH)3(胶体)的制备方法:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 。如果将溶液加热蒸干HCl会挥发最后得到Fe(OH)3,将之灼烧产物为Fe2O3。
Fe(OH)3(胶体)+3HCl 。如果将溶液加热蒸干HCl会挥发最后得到Fe(OH)3,将之灼烧产物为Fe2O3。
(2)B为AlCl3,有0.3mol。①KOH不足,Al3++3OH-=Al(OH)3产生Al(OH)30.1mol,则KOH为0.3mol,故KOH浓度为3mol/L。②KOH过量,Al3+ + 3OH- = Al(OH)3 ,Al(OH)3 + OH- = AlO2- + H2O ,故KOH为1.1mol。故KOH浓度为11mol/L。
(3)负极是金属铝单质失电子变为Al3+,少量的Al3+与过量的OH-,继续反应生成AlO2-与H2O。故电极反应式为:Al-3e-+4OH-=AlO2一+2H2O。
(4)由题意知,该反应是CO2+C=2CO,故C为CO2,CO2是共价化合物,其电子式为![]() 。CO2气体通入KOH溶液会发生反应:CO2+2OH—=CO32—+H2O,F为K2CO3溶液,所以溶液中离子浓度由大到小的顺序是c(K+)>c(CO32一)>c(OH一)>c(HCO3一)>c(H+)。
。CO2气体通入KOH溶液会发生反应:CO2+2OH—=CO32—+H2O,F为K2CO3溶液,所以溶液中离子浓度由大到小的顺序是c(K+)>c(CO32一)>c(OH一)>c(HCO3一)>c(H+)。


