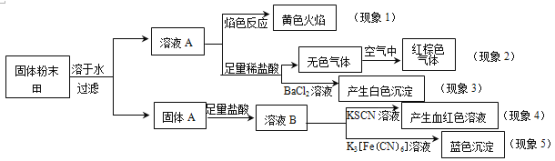
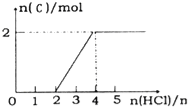
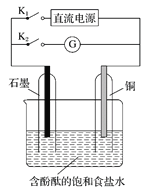
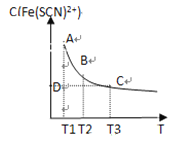
题目内容
【题目】某元素Y的核外电子数等于核内中子数,取2.8g该元素的单质与氧气充分反应,可得6.0g化合物YO2,则该元素在周期表中位置( )
A. 第三周期 B. 第一周期 C. 第ⅤA族 D. 第ⅥA族
【答案】A
【解析】试题分析:2.8g该元素的单质与氧气充分反应,可得6.0g化合物YO2,则2.8g单质与3.2g氧气反应,n(O2)=![]() =0.1mol,由R+O2=RO2可知,M(R)=
=0.1mol,由R+O2=RO2可知,M(R)=![]() =28g/mol,再结合核外电子数等于核内中子数来解答.
=28g/mol,再结合核外电子数等于核内中子数来解答.
解:2.8g该元素的单质与氧气充分反应,可得6.0g化合物YO2,则2.8g单质与3.2g氧气反应,n(O2)=![]() =0.1mol,由R+O2=RO2可知,M(R)=
=0.1mol,由R+O2=RO2可知,M(R)=![]() =28g/mol,又核外电子数等于核内中子数,则质子数为14,为Si元素,位于元素周期表的第三周期ⅣA族,
=28g/mol,又核外电子数等于核内中子数,则质子数为14,为Si元素,位于元素周期表的第三周期ⅣA族,
故选A.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目