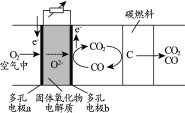
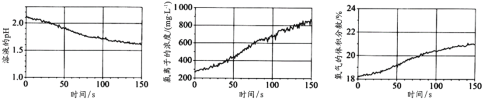
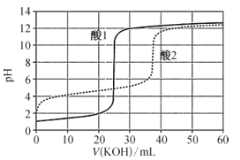
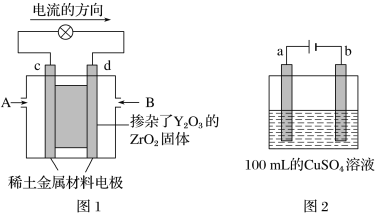
题目内容
【题目】已知有以下物质相互转化。其中A为金属试回答:

(1)写出B的化学式________________,D的化学式________________。
(2)写出由D转变成H的化学方程式________________。
(3)写出向G溶液加入A的有关离子反应方程式________________。
(4)写出E转变为F的实验现象为:_________________________化学方程式:___________________。
【答案】FeCl2 KCl KCl+AgNO3=AgCl↓+KNO3 2Fe3++Fe =3Fe2+ 生成白色沉淀,迅速变成灰绿色,最后变成红褐色 4Fe(OH)2+O2+2H2O═4Fe(OH)3
【解析】
依据转化关系中的反应现象可以判断,白色沉淀E为Fe(OH)2,红褐色沉淀F为Fe(OH)3,D溶液加入硝酸酸化的硝酸银生成白色沉淀H为AgCl,生成的溶液中含有钾离子,证明D溶液为KCl,依据转化关系得到,C为KOH,B为FeCl2,F溶解于盐酸,说明加盐酸溶解生成的G为FeCl3,判断A为Fe;
D和硝酸银反应生成白色沉淀H,H不溶于稀硝酸,所以H是氯化银,则D中含有氯离子,D和硝酸银混合溶液进行焰色反应呈紫色,则D中含有钾元素,所以D是氯化钾,白色沉淀E和氧气反应生成红褐色沉淀F,则F是氢氧化铁,E是氢氧化亚铁,氢氧化铁和盐酸反应生成氯化铁溶液,所以G是氯化铁,氯化铁和A反应生成B,B和C反应生成氯化钾和氢氧化亚铁,所以A是铁,B是氯化亚铁,C是氢氧化钾。
(1) 通过以上分析知,B是氯化亚铁,D是氯化钾,B和D的化学式分别是:FeCl2、KCl,
故答案为:FeCl2;KCl;
(2) D是KCl,H为AgCl,D转变成H的化学方程式为KCl+AgNO3=AgCl↓+KNO3,
故答案为:KCl+AgNO3=AgCl↓+KNO3;
(3) G为FeCl3,A为Fe,它们之间的反应发生氧化还原反应,2Fe3++Fe =3Fe2+,
故答案为:2Fe3++Fe =3Fe2+;
(4) E是氢氧化亚铁,F是氢氧化铁,氢氧化亚铁和氧气。水反应生成氢氧化铁,实验现象为:生成白色沉淀,迅速变成灰绿色,最后变成红褐色,反应方程式为:4 Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:生成白色沉淀,迅速变成灰绿色,最后变成红褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3。

【题目】元素X、Y、Z和W在周期表中的位置如图所示,其中X、Y、Z均为短周期元素,且X、Y、W原子的最外层电子数之和为13。下列说法不正确的是( )
X | Y | ||
Z | |||
W |
A. 原子半径:![]()
B. W的最高价氧化物对应的水化物可能为强碱
C. 上述四种元素可形成化合物![]()
D. 一定条件下,Z单质与X的氢化物及Y的氢化物均能反应