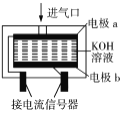
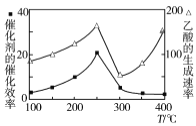
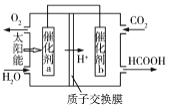
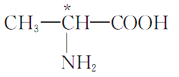题目内容
【题目】NA 为阿伏加德罗常数的值。下列说法正确的是 ( )
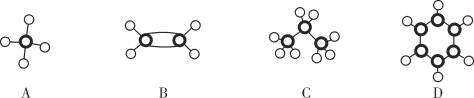
A.18g![]() 和
和![]() 的混合物中,所含中子数为 10 NA
的混合物中,所含中子数为 10 NA
B.标准状况下,2.24L SO3 中含有的氧原子数目为 0.3 NA
C.物质的量浓度为 0.1molL﹣1 的 MgCl2 溶液中,含有 Cl﹣个数为 0.2 NA
D.一定条件下,2.3g 的金属钠完全与氧气反应时生成 3.6g 产物时失去的电子数为 0.1NA
【答案】D
【解析】
A.![]() 和
和![]() 的摩尔质量均为20g/mol,故18g混合物的物质的量为0.9mol,两者均含10个中子,故0.9mol混合物所含中子数为 9NA,A项错误;
的摩尔质量均为20g/mol,故18g混合物的物质的量为0.9mol,两者均含10个中子,故0.9mol混合物所含中子数为 9NA,A项错误;
B.SO3在标准状况下为固体,不能用气体摩尔体积来计算其物质的量,B项错误;
C.溶液体积不明确,无法计算氯离子的个数,C项错误;
D. 2.3g 的金属钠物质的量为0.1mol,钠与氧气发生反应化合价变为+1,故0.1mol钠反应失去0.1 NA个电子;
答案选D。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。
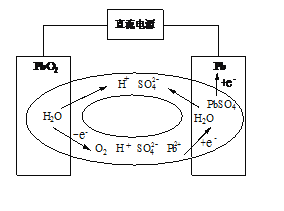
(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。