题目内容
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间的变化如图所示,如图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间的变化如图所示,如图可得出的正确结论是
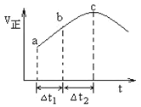
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段大于b~c段
【答案】C
【解析】
A.反应达到平衡时的标志是:v正=v逆,而不是v正最大,据此分析A项;
B.随着反应的进行,反应物浓度逐渐减小,据此分析B项;
C.随着反应的不断进行,反应速率逐渐加快,说明该反应为放热反应,据此分析C项;
D.随着反应的进行,SO2不断消耗,转化率=消耗量/起始量×100%,据此分析D项。
A项,反应达到平衡时,v正=v逆,c点v正最大,但未达到平衡,故A错误;
B项,随着反应的进行,反应物浓度逐渐减小,所以a点反应物浓度大于b点的,故B错误;
C项,反应初始阶段,随着反应的进行,反应速率逐渐加快,说明该反应为放热反应,即反应物的总能量大于生成物的总能量,故C正确;
D项,随着反应的进行,SO2的转化率逐渐增大,所以b~c段的转化率大于a~b段,故D错误;
故答案选C。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目