题目内容
【题目】某同学用正盐X(三种常见元素组成的纯净物,摩尔质量为270g/mol)进行如下实验:
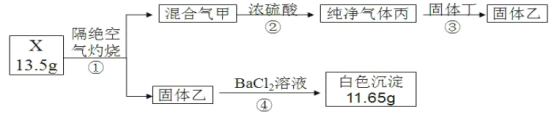
步骤②是工业生产制备某种常见试剂的重要环节。实验中观测到:丙能使带火星的木条复燃;乙和丁均为纯净物,且含有相同元素,焰色反应透过蓝色钴玻璃呈紫色;在步骤③中,恰好完全反应时消耗丁7.9g。
请回答:
(1)X的化学式是________,步骤③的化学方程式是________。
(2)X在Ag+的催化作用下能和Mn2+反应,可观察到溶液由无色变紫红色,写出对应的离子方程式________。
【答案】K2S2O8 2K2S2O8+O2=2K2SO4 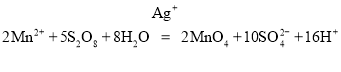
【解析】
丙能使带火星的木条复燃,则丙为氧气,乙和丁均为纯净物,且含有相同元素,焰色反应透过蓝色钴玻璃呈紫色,乙与氯化钡溶液反应生成白色沉淀,则固体乙应为硫酸钾,氧气与固体丁反应得到固体乙,则丁为亚硫酸钾,混合气体甲通过浓硫酸后只得到丙,结合分析可知,甲中可能含有三氧化硫,正盐X(三种常见元素组成的纯净物,摩尔质量为270g/mol),13.5gX为0.05mol,白色沉淀也为0.05mol,若为硫酸钡,质量为11.65g,符合所推结果,在步骤③中,恰好完全反应时消耗丁7.9g,则消耗亚硫酸钾![]() =0.05mol,则消耗氧气的物质的量为0.025mol,0.05molX隔绝空气灼烧得到0.05molK2SO4、0.025molO2,13.5g-0.05mol×174g/mol-0.025mol×32g/mol=4.0g,则生成的三氧化硫的物质的量为
=0.05mol,则消耗氧气的物质的量为0.025mol,0.05molX隔绝空气灼烧得到0.05molK2SO4、0.025molO2,13.5g-0.05mol×174g/mol-0.025mol×32g/mol=4.0g,则生成的三氧化硫的物质的量为![]() =0.05mol,则X中NK:NS:NO=
=0.05mol,则X中NK:NS:NO=![]() :
:![]() :
:![]() =2:2:8,故X的化学式为K2S2O8。
=2:2:8,故X的化学式为K2S2O8。
(1)X的化学式是K2S2O8,步骤③亚硫酸钾与氧气反应生成硫酸钾,反应的化学方程式是2K2SO3+O2=2K2SO4;
(2)X在Ag+的催化作用下能和Mn2+反应,可观察到溶液由无色变紫红色,则生成高锰酸钾和硫酸钾,对应的离子方程式为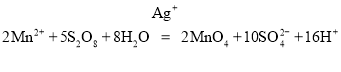 。
。

【题目】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为______________________________;
(2)写出与H2O分子互为等电子体的微粒_________________________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是______________
A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_________(请用相应的编号填写)
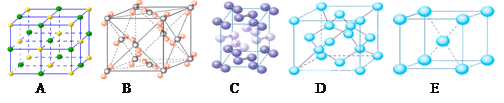
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能” 是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出生成此配离子的离子方程式:__________________________________________________________。
【题目】中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。下列关于KNO3的古代文献,对其说明不合理的是
选项 | 目的 | 古代文献 | 说明 |
A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,则祸不可测”——《天工开物》 | KNO3能自燃 |
B | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4);“强烧之,紫青烟起,云是硝石也”——《本草经集注》 | 利用焰色反应 |
C | 提纯 | “(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”——《开宝本草》 | 溶解,蒸发结晶 |
D | 性质 | “(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”——《本草纲目》 | 利用KNO3的氧化性 |
A.AB.BC.CD.D