题目内容
甲烷燃料电池(电解质是KOH溶液)的总反应为:CH4+2KOH+2O2=K2CO3+3H2O. 下列有关的说法中不正确的是( )A.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
B.该燃料电池在使用过程中电解质溶液的浓度和性质均发生变化
C.负极反应式:CH4+3H2O-8e-=CO32-+7H+
D.正极反应式:2O2+4H2O+8e-=8OH-
【答案】分析:A、根据原电池的能量转化以及燃烧反应的能量转化来回答;
B、根据燃料电池的电池反应来回答;
C、具有还原性的甲烷为原电池的负极,发生氧化反应;
D、通入氧气的一极为原电池的正极,发生还原反应.
解答:解:A、在燃料电池工作时,化学能大多数转化为电能,甲烷燃烧伴随着光能和热能,甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大,故A正确;
B、燃料电池在使用过程中发生电池反应:CH4+2KOH+2O2=K2CO3+3H2O,电解质氢氧化钾被消耗,生成碳酸钾溶液,电解质溶液的浓度和性质均发生变化,故B正确;
C、甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,故C错误;
D、通入氧气的一极为原电池的正极,发生还原反应,电极反应式为2O2+4H2O+8e-=8OH-,故D正确.
故选C.
点评:本题考查学生燃料电池的工作原理知识,可以根据所学知识进行回答,难度不大.
B、根据燃料电池的电池反应来回答;
C、具有还原性的甲烷为原电池的负极,发生氧化反应;
D、通入氧气的一极为原电池的正极,发生还原反应.
解答:解:A、在燃料电池工作时,化学能大多数转化为电能,甲烷燃烧伴随着光能和热能,甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大,故A正确;
B、燃料电池在使用过程中发生电池反应:CH4+2KOH+2O2=K2CO3+3H2O,电解质氢氧化钾被消耗,生成碳酸钾溶液,电解质溶液的浓度和性质均发生变化,故B正确;
C、甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,故C错误;
D、通入氧气的一极为原电池的正极,发生还原反应,电极反应式为2O2+4H2O+8e-=8OH-,故D正确.
故选C.
点评:本题考查学生燃料电池的工作原理知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
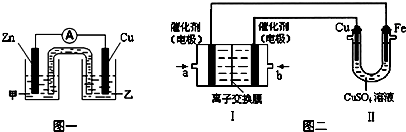
 如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O,通过装置Ⅱ实现铁棒上镀铜.下列说法正确的是( )
如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),电池总反应为:CH4+2O2+2KOH=K2CO3+3H2O,通过装置Ⅱ实现铁棒上镀铜.下列说法正确的是( )
 Cu(OH)2+2H+
Cu(OH)2+2H+