题目内容
CuSO4溶液是中学化学及工农业生产中常见的一种试剂.
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是
(2)该同学利用制得的CuSO4溶液,进行以下实验探究.
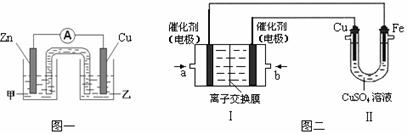
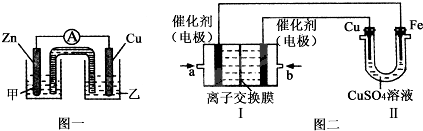
①图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池.电解质溶液甲是

②图二中,I是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在II中实现铁上镀铜,则b处通入的是
(3)将蓝矾(CuSO4?5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其有效成分为难溶的碱式硫酸铜[xCuSO4?yCu(OH)2].为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体.所得数据显示n(HCl):n(CuO)=3:2,则该碱式硫酸铜的化学式中x:y=
(1)某同学配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是
Cu2++2H2O Cu(OH)2+2H+
Cu(OH)2+2H+
 Cu(OH)2+2H+
Cu(OH)2+2H+Cu2++2H2O Cu(OH)2+2H+
Cu(OH)2+2H+
. Cu(OH)2+2H+
Cu(OH)2+2H+(2)该同学利用制得的CuSO4溶液,进行以下实验探究.
①图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池.电解质溶液甲是
ZnSO4
ZnSO4
(填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是Cu2++2e-=Cu
Cu2++2e-=Cu
.
②图二中,I是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在II中实现铁上镀铜,则b处通入的是
O2
O2
(填“CH4”或“O2”),a处电极上发生的电极反应式是CH4-8e-+10OH-=CO32-+7H2O
CH4-8e-+10OH-=CO32-+7H2O
.若把II中电极均换为惰性电极,电解时的化学反应方程式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4
| ||
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
.若把II中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体为672mL(标准状况下)时,溶液的pH=
| ||
1
1
(假设电解后溶液体积不变).(3)将蓝矾(CuSO4?5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其有效成分为难溶的碱式硫酸铜[xCuSO4?yCu(OH)2].为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体.所得数据显示n(HCl):n(CuO)=3:2,则该碱式硫酸铜的化学式中x:y=
1:3
1:3
.分析:(1)铜离子水解,加硫酸抑制水解;
(2)①负极为Zn,电解质溶液中含锌离子;Cu为正极,得到电子发生还原反应;
②铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,a为负极;惰性电极电解硫酸铜溶液生成硫酸、Cu、氧气;II中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,阳极产生的气体为672mL为氯气和氧气,以此计算;
(3)利用xCuSO4?yCu(OH)2~yCuCl2~2yHCl~(x+y)CuO,结合n(HCl):n(CuO)=3:2来计算.
(2)①负极为Zn,电解质溶液中含锌离子;Cu为正极,得到电子发生还原反应;
②铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,a为负极;惰性电极电解硫酸铜溶液生成硫酸、Cu、氧气;II中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,阳极产生的气体为672mL为氯气和氧气,以此计算;
(3)利用xCuSO4?yCu(OH)2~yCuCl2~2yHCl~(x+y)CuO,结合n(HCl):n(CuO)=3:2来计算.
解答:解:(1)铜离子水解,加硫酸抑制水解,水解离子反应为Cu2++2H2O Cu(OH)2+2H+,故答案为:Cu2++2H2O
Cu(OH)2+2H+,故答案为:Cu2++2H2O Cu(OH)2+2H+;
Cu(OH)2+2H+;
(2)①负极为Zn,电解质溶液中含锌离子,则电解质溶液甲为ZnSO4,Cu为正极,得到电子发生还原反应,电极反应为Cu2++2e-=Cu,故答案为:ZnSO4;Cu2++2e-=Cu;
②铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,即b处通入O2,a处电极上发生的电极反应式是CH4-8e-+10OH-=CO32-+7H2O,
惰性电极电解硫酸铜溶液生成硫酸、Cu、氧气,该电解反应为2CuSO4+2H2O
2Cu+O2↑+2H2SO4,
II中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,阳极产生的气体为672mL为氯气和氧气,
气体的总物质的量为
=0.03mol,由2Cl--2e-=Cl2↑可知,氯气为0.02mol,所以氧气为0.01mol,由4OH--4e-=2H2O+O2↑~4H+,n(H+,)=0.04mol,c(H+,)=
=0.1mol/L,所以pH=1,
故答案为:O2;CH4-8e-+10OH-=CO32-+7H2O;2CuSO4+2H2O
2Cu+O2↑+2H2SO4;1;
(3)由xCuSO4?yCu(OH)2~yCuCl2~2yHCl~(x+y)CuO,
n(HCl):n(CuO)=3:2,则2y:(x+y)=3:2,
解得x:y=1:3,故答案为:1:3.
 Cu(OH)2+2H+,故答案为:Cu2++2H2O
Cu(OH)2+2H+,故答案为:Cu2++2H2O Cu(OH)2+2H+;
Cu(OH)2+2H+;(2)①负极为Zn,电解质溶液中含锌离子,则电解质溶液甲为ZnSO4,Cu为正极,得到电子发生还原反应,电极反应为Cu2++2e-=Cu,故答案为:ZnSO4;Cu2++2e-=Cu;
②铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,即b处通入O2,a处电极上发生的电极反应式是CH4-8e-+10OH-=CO32-+7H2O,
惰性电极电解硫酸铜溶液生成硫酸、Cu、氧气,该电解反应为2CuSO4+2H2O
| ||
II中电极均换为惰性电极,电解液换为含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,阳极产生的气体为672mL为氯气和氧气,
气体的总物质的量为
| 0.672L |
| 22.4L/mol |
| 0.04mol |
| 0.4L |
故答案为:O2;CH4-8e-+10OH-=CO32-+7H2O;2CuSO4+2H2O
| ||
(3)由xCuSO4?yCu(OH)2~yCuCl2~2yHCl~(x+y)CuO,
n(HCl):n(CuO)=3:2,则2y:(x+y)=3:2,
解得x:y=1:3,故答案为:1:3.
点评:本题主要考查原电池及利用守恒法的计算,题目综合性较大,涉及盐类水解、原电池、电解池、利用关系式计算等,注重对高考常考考点的考查,且注重知识的迁移和能力提升的训练,题目难度中等.

练习册系列答案
相关题目

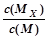 将增大
将增大