题目内容
根据下图装置进行实验,已知:Na2O2与H2O和CO2都能反应并生成O2,但与NH3不反应
回答下列问题:。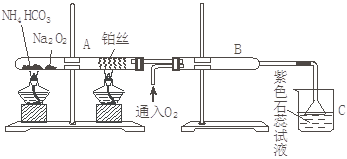
(1)在受热的试管A中NH4HCO3发生反应的化学方程式为: 。
(2)被加热的铂丝处发生的化学方程式为:___________________________________。
(3)B中出现的现象为:___________________________________________________。
(4)烧杯C中发生的现象为________________________________________________。
(5)倒置漏斗的作用 。
(1)NH4HCO3 CO2 ↑+NH3↑+H2O
CO2 ↑+NH3↑+H2O
(2)4NH3+5O2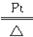 4NO+6H2O
4NO+6H2O
(3)出现红棕色气体
(4)紫色石蕊试液变红
(5)防止倒吸
解析试题分析:(1) NH4HCO3发生反应的化学方程式为:NH4HCO3 CO2 ↑+NH3↑+H2O
CO2 ↑+NH3↑+H2O
(2)A处的碳酸氢铵分解产生二氧化碳、水、氨气,前两者又与过氧化钠反应产生氧气,所以氨气、氧气在铂作催化剂加热的条件下发生催化氧化反应,化学方程式为4NH3+5O2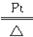 4NO+6H2O
4NO+6H2O
(3)氨催化氧化的产物一氧化氮与氧气结合生成红棕色的二氧化氮气体,所以B中出现红棕色气体
(4)二氧化氮与水反应生成硝酸,使紫色石蕊试液变红,所以C中的现象是紫色石蕊试液变红
(5)倒放的漏斗的作用是防止倒吸,原理是当易溶性气体被吸收液吸收时,导管内压强减少,吸收液上升到漏斗中,由于漏斗容积较大,导致烧杯中液面下降,使漏斗口脱离液面,漏斗中的吸收液受自身重力的作用又流回烧瓶内,从而防止吸收液的倒吸。
考点:考查铵盐的受热分解,过氧化钠的化学性质,氨气的催化氧化,二氧化氮的性质及防倒吸装置

 优学名师名题系列答案
优学名师名题系列答案(18分) (1)某实验小组的甲同学用图l所示装置制取少量乙酸乙酯(加热设备及夹持固定装置均略去)。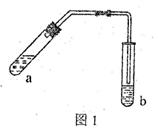

①试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是 。
②试管a中加入碎瓷片的作用是 ,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填序号)。
| A.立即补加 | B.不需补加 | C.冷却后补加 | D.重新配料 |
④试管b中盛有饱和Na2CO3溶液,其作用是 。
⑤反应结束后,振荡试管b,静置。观察到的现象是 。
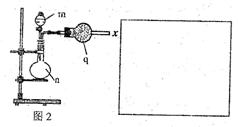
(2)该小组的乙同学利用图2所示装置制备并收集干燥的NO2气体。
①图2中仪器n的名称是 。
②请在方框内画出用集气瓶收集NO2的装置图。
③写出仪器n中发生反应的离子方程式: 。
(3)该小组的丙同学利用图2所示装置制取NH3和O2的混合气体,并且利用图3所示装置验证NH3的某些性质。m中加入浓氨水,q中加入碱石灰,e内放置催化剂(铂石棉),按气流方向连接各仪器x→y→z→h。
①图2仪器n内需加入固体试剂的名称为 。
②实验中观察到e内有红棕色气体出现,证明氨气具有 性,e中发生反应的化学方程式为 。
如图1所示是实验室中制取气体的一种简易装置。
(1)请简述检验它的气密性的方法 。
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为________________________。
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。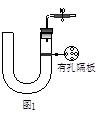
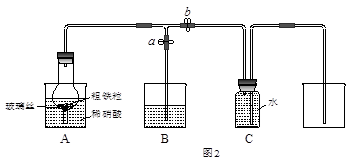
(3)已知16.9%稀硝酸的密度为1.10g·cm-3,则其物质的量浓度为____________(计算结果保留两位小数)。若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、 。
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是 。B装置烧杯中液体的作用是_________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(5)现有仪器和药品:试管和胶头滴管,0.1mol·L-1KSCN溶液、0.2mol·L-1酸性KMnO4溶液、0.1mol·L-1KI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液。 | |
| 第二步 | | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+。 |


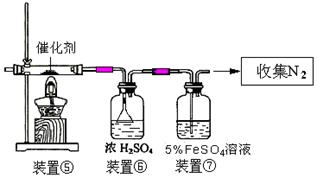
 MnCl2 + C12↑+ 2 H2O):
MnCl2 + C12↑+ 2 H2O):

 KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )