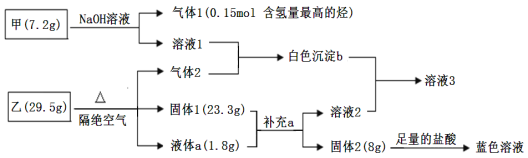
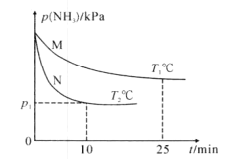
题目内容
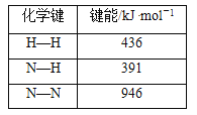
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
下列说法正确的是( )
A.该反应为吸热反应
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=92 kJ·mol-1
D.生成1 mol NH3放出92 kJ热量
【答案】B
【解析】
由反应热△H=断裂化学键吸收的能量之和-形成化学键释放的能量之和可得合成氨反应的反应热△H=946kJ/mol+3×436kJ/mol-391kJ/mol×6=-92kJ/mol<0,该反应为放热反应。
A项、合成氨反应的反应热△H=-92kJ/mol<0,该反应为放热反应,故A错误;
B项、该反应为放热反应,放热反应中反应物的总能量高于生成物的总能量,故B正确;
C项、合成氨反应的反应热△H=-92kJ/mol,故C错误;
D项、合成氨反应的反应热△H=-92kJ/mol,由方程式可知,生成2mol NH3放出92 kJ热量,故D错误;
故选B。

练习册系列答案
相关题目