��Ŀ����
����Ŀ�������̿�ۣ���Ҫ����MnO2��������������Fe2O3��Al2O3�����ʣ�Ϊԭ���Ʊ��ߴ�MnO2����������ͼ��ʾ��
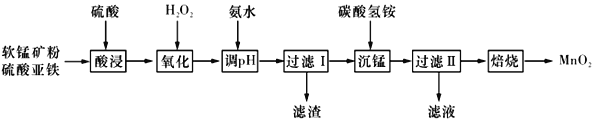
��֪���ٳ����£�Ksp[Fe(OH)3]=8.0��10-38��Ksp [Al(OH)3]=4.0��10-34��
�ڳ����£��������������������Al3+��Fe3+��ȫ������pH�ֱ�Ϊ4.6��3.4��Mn2+��ʼ������pHΪ8.1��
�۳����£�����Һ�н����������ʵ���Ũ��С�ڻ����1��10-5mol��L-lʱ������Ϊ�ý��������ѱ�������ȫ��
��1��������������в�����Ũ����������ᣬԭ����_____________________���������ʱ����һ���������ᣬ����ܹ������١������ᡱ������ɰ�����ʧ���������ʱ���������ʱ���к��ɫ�����֣�ԭ����___________________________________��
��2�����백ˮӦ����pH�ķ�ΧΪ______����Fe3+ǡ�ó�����ȫʱ��c(Al3+)=________mol��L-l��
��3�������ˡ���������ΪMnCO3����Һ�����ʵ���Ҫ�ɷ���____________���ѧʽ����д���������ӵĵ���ʽ��_______________________________��
��4������̼����鱗��������Ĺ��̳�Ϊ�����̡���
�١����̡������зų�CO2������Ӧ�����ӷ���ʽΪ_______________________________��
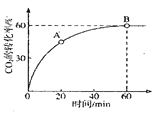
�ڡ����̡������г����������¶ȵĹ�ϵ��ͼ��ʾ�����¶ȸ���60��ʱ���������������¶����߶�������ԭ�������_______________________________��
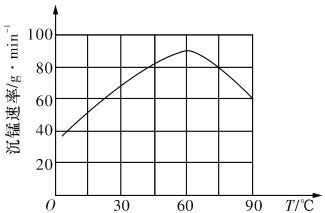
���𰸡� �������̻�����Ũ���� ���ɵ�Fe3+ˮ��õ�Fe(OH)3���� 4.6~8.1 0.05 (NH4)2SO4 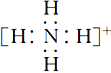 Mn2++2HCO3-=MnCO3��+CO2��+H2O �¶ȹ���ʱ̼����淋ķֽ����������ӿ죬����������̼�����Ũ�ȵļ�С������
Mn2++2HCO3-=MnCO3��+CO2��+H2O �¶ȹ���ʱ̼����淋ķֽ����������ӿ죬����������̼�����Ũ�ȵļ�С������
����������1��������������в�����Ũ����������ᣬԭ���Ƕ������̻�����Ũ�������������ʱ����һ���������ᣬ����ܹ������١���������������ɰ�����ʧ���������ʱ���������ʱ���к��ɫ�����֣�ԭ�������ɵ�Fe3+ˮ��õ�Fe(OH)3������
��2����������Ϣ��֪��Al3+��Fe3+��ȫ������pH�ֱ�Ϊ4.6��3.4��Mn2+��ʼ������pHΪ8.1�����ԣ����백ˮӦ����pH�ķ�ΧΪ4.6~8.1����Fe3+ǡ�ó�����ȫʱ�������ʵ���Ũ�����ֵΪ1��10-5mol��L-l����ʱ��Һ��c(OH-)����СֵΪ![]() mol/L��c(Al3+)=
mol/L��c(Al3+)=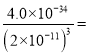 0.05mol��L-l��
0.05mol��L-l��
��3������������������ΪMnCO3����Һ�����ʵ���Ҫ�ɷ���(NH4)2SO4���������ӵĵ���ʽΪ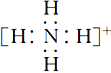 ��
��
��4�����������������зų�CO2������Ӧ�����ӷ���ʽΪMn2++2HCO3-=MnCO3��+CO2��+H2O��
�ڵ��¶ȸ���60��ʱ���������������¶����߶�������ԭ����������¶ȹ���ʱ̼����淋ķֽ����������ӿ죬����������̼�����Ũ�ȵļ�С��������