题目内容
【题目】金刚石和石墨均为碳的同素异形体,氧气不足时它们燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示。
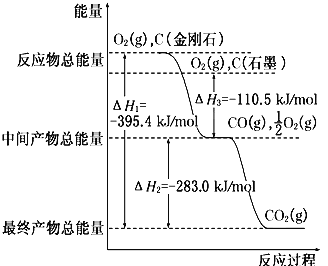
(1)写出石墨转化为金刚石的热化学方程式____________________________________。
(2)写出石墨和二氧化碳反应生成一氧化碳的热化学方程式_____________________。
(3)科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
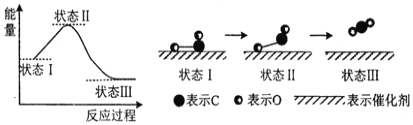
①判断CO和O生成CO2是放热反应的依据是__________________。
②写出CO2的电子式___________________,CO2含有的化学键类型是(若含共价键,请标明极性或非极性)______________________。
【答案】C(s,石墨)=C(s,金刚石)△H=+1.9 kJ/molC(s,石墨)+CO2(g)=2CO(g)△H=+172.5 kJ/mol状态I的能量高于状态III的能量![]() 极性共价键
极性共价键
【解析】
(1)根据图像可知石墨的总能量低于金刚石,石墨转化为金刚石的反应热为+(395.4-283.0-110.5)kJ/mol=+1.9 kJ/mol,因此石墨转化为金刚石的热化学方程式为C(s,石墨)=C(s,金刚石)△H=+1.9kJ/mol。
(2)根据图像可知:
①C(s,石墨)+1/2O2(g)=CO(g)△H=-110.5 kJ/mol
②CO(g)+1/2O2(g)=CO2(g)△H=-283.0 kJ/mol
根据盖斯定律可知①-②即可得到石墨和二氧化碳反应生成一氧化碳的热化学方程式为C(s,石墨)+CO2(g)=2CO(g)△H=+172.5 kJ/mol。
(3)①根据图像可知状态I的能量高于状态III的能量,所以CO和O生成CO2是放热反应。
②二氧化碳是共价化合物,则CO2的电子式为![]() ,碳氧是不同的非金属元素,则CO2含有的化学键类型是极性共价键。
,碳氧是不同的非金属元素,则CO2含有的化学键类型是极性共价键。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】甲乙两同学对保存已久的Na2SO3试剂进行试验探究。取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解。
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)_____________________________________
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是________________________________
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸钾溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
实验步骤 | 预期现象和结论 |
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置。 | |
步骤2:取适量步骤1所得溶液于试管中 加入少量的____________________溶液。 | 若溶液褪色,说明其有_________若溶液不褪色,说明其中没有______ |
步骤3: 再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴 加___________溶液。 | 如果有白色沉淀生成,则说明其中有_____________,已经变质。 如果没有白色沉淀生成,则说明其中 没有_____________ |
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量。实验如下:
①配制250ml 约0.2molL-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入____________,洗涤,定容,摇匀。
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05molL-1酸性高锰酸钾装入50ml__________(填酸式或碱式)滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4VmL。
③计算Na2SO3的质量分数=______________(只列出计算式,不要求算出结果)