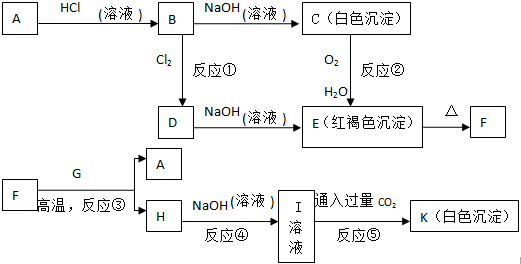
题目内容
1.下列热化学方程式书写正确的是( )| A. | 2SO2+O2=2SO3△H=-196.6kJ•mol-1 | |
| B. | N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1 | |
| C. | C(s)+O2(g)=CO2(g)△H=+393.51kJ•mol-1 | |
| D. | H2O(l)=H2(g)+$\frac{1}{2}$O2(g)△H=+285.8kJ•mol-1 |
分析 根据热化学方程式的书写方法:注明物质的聚集状态;标明焓变的单位以及符号,据此回答.
解答 解:A、该式子没有注明物质的聚集状态,故A错误;
B、氮气和氧气的化合反应是放热的,焓变是负值,故B错误;
C、物质碳的燃烧是放热的,焓变是负值,故C错误;
D、水分解是吸热的过程,改写法符合热化学方程式的书写原则,故D正确.
故选D.
点评 本题既考查了热化学方程式书写方法,题目难度不大,注意基本知识的理解和应用是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列是氧化还原反应也是吸热反应的是( )
| A. | 灼热的炭与二氧化碳反应 | |
| B. | 铁和稀硫酸的反应 | |
| C. | 氢氧化钡晶体的粉末和氯化铵晶体混合 | |
| D. | 钢铁制品生锈的反应 |
12.下列化合物不能由化合反应直接制得的是( )
| A. | FeCl2 | B. | Na2O | C. | Fe( OH)3 | D. | H2SiO3 |
9.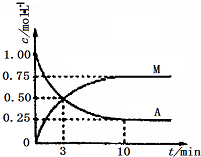 已知:A(g)+3B(g)?M(g)+N(g);△H=-49.0kJ•mol-1.一定条件下,向体积为2L的密闭容器中充入2mol A和6molB,测得A和M的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:A(g)+3B(g)?M(g)+N(g);△H=-49.0kJ•mol-1.一定条件下,向体积为2L的密闭容器中充入2mol A和6molB,测得A和M的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
 已知:A(g)+3B(g)?M(g)+N(g);△H=-49.0kJ•mol-1.一定条件下,向体积为2L的密闭容器中充入2mol A和6molB,测得A和M的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:A(g)+3B(g)?M(g)+N(g);△H=-49.0kJ•mol-1.一定条件下,向体积为2L的密闭容器中充入2mol A和6molB,测得A和M的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )| A. | 充分反应后该反应放出98 kJ的热量 | |
| B. | 10min后,升高温度能使$\frac{n(M)}{n(A)}$增大 | |
| C. | 3min时B的生成速率是M生成速率的3倍 | |
| D. | 反应到达平衡时刻B的转化率为75% |
16.某有机物和过量的钠反应制得V1L气体,另一份等质量的该有机物和足量的碳酸氢钠反应制得V2气体(同温同压下测定),若V1=V2≠0,则该有机物可能是( )
| A. | HOCH2CH2COOH | B. | CH3COOH | C. | HOOC-COOH | D. | 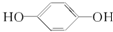 |
6.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23 g钠充分燃烧时转移电子数为1 NA | |
| D. | 235 g核素${\;}_{92}^{239}$U发生裂变反应:${\;}_{92}^{239}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |
13.燃煤是造成大气污染的主要原因,利用下列反应可降低污染并回收硫:SO2(g)+2CO(g)?2CO2(g)+S(l)△H<0,下列有关该反应的判断不正确的是( )
| A. | 选择不同催化剂,可以改变反应速率,不改变△H | |
| B. | 及时分离液态硫,能提高SO2的转化率 | |
| C. | 在恒容恒温容器中反应,气体压强不变时达到平衡状态 | |
| D. | 升高温度,正、逆反应速率均增大,n(CO)增大 |