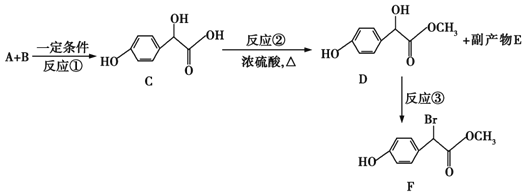
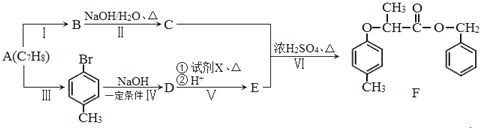
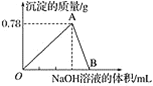
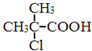��Ŀ����
����Ŀ��FeCl3��һ�ֺ���Ҫ�����Σ���Ҫ������ˮ����������Ч���á��۸���˵��ŵ㡣��ҵ�Ͽɽ���м���������У�������FeCl2����ͨ��Cl2�������Ʊ�FeCl3��Һ��
��1������״���µ�aL�Ȼ�����������100gˮ�У��õ�������ܶ�Ϊbg��mL��1�������������ʵ���Ũ����______________________��
��2����100mL��FeBr2��Һ��ͨ���״����Cl23.36L����Ӧ�����Һ��Cl����Br�������ʵ���Ũ����ȣ���ԭFeBr2��Һ�����ʵ���Ũ��Ϊ__________________��
��3��FeCl3��Һ����������ˮ���侻ˮ��ԭ��Ϊ___________________________(�����ӷ���ʽ��ʾ)����100mL2mol��L��1��FeCl3��Һ��ˮʱ�����ɾ��о�ˮ���õ�����________(����������������������С����)0.2NA��
��4��ClO2����ˮ��Fe2����Mn2����S2����CN���������Ե�ȥ��Ч����ij������ˮ�к�CN��bmg/L������ClO2��CN��������ֻ�������������壬�����ӷ�Ӧ����ʽΪ________________������100m3������ˮ��������ҪClO2____mol��
���𰸡�![]() mol��L��1 2mol��L��1 Fe3����3H2O
mol��L��1 2mol��L��1 Fe3����3H2O![]() Fe(OH)3(����)��3H�� �� 2ClO2��2CN��===N2��2CO2��2Cl��
Fe(OH)3(����)��3H�� �� 2ClO2��2CN��===N2��2CO2��2Cl�� ![]()
��������
��1��![]() ����Һ����Ϊ
����Һ����Ϊ![]() ������Һ���Ϊ
������Һ���Ϊ �����
�����![]() ���㣻
���㣻
��2����ԭ��Fe2+>Br��ͨ�������ȷ�����Ӧ![]() ��Fe2+��Ӧ��ϣ�ʣ��������ٷ�����Ӧ
��Fe2+��Ӧ��ϣ�ʣ��������ٷ�����Ӧ![]() ����Ӧ����Һ��Cl��Br�����ʵ���Ũ����ȣ�˵��������ȫ��Ӧ��Cl2�����ʵ���Ϊ
����Ӧ����Һ��Cl��Br�����ʵ���Ũ����ȣ�˵��������ȫ��Ӧ��Cl2�����ʵ���Ϊ![]() ����Brû�з�Ӧ����Һ��n(Br)=0.3mol����n(FeBr2)=0.15mol��0.15molFe2+ֻ������0.075mol��Cl2�����в���Br�μӷ�Ӧ����FeBr2�����ʵ���Ϊx����ʾ���μӷ�Ӧ��n(Br)�����ݵ���ת���غ��з��̼���xֵ���ٸ���c=nV���㣻
����Brû�з�Ӧ����Һ��n(Br)=0.3mol����n(FeBr2)=0.15mol��0.15molFe2+ֻ������0.075mol��Cl2�����в���Br�μӷ�Ӧ����FeBr2�����ʵ���Ϊx����ʾ���μӷ�Ӧ��n(Br)�����ݵ���ת���غ��з��̼���xֵ���ٸ���c=nV���㣻
��3��������ˮ���Ʊ����壬����ɾ���ˮ����ˮ�ⷴӦΪ���淴Ӧ��
��4��ClO2��CN��������ֻ��������������N2��CO2���ٸ��ݻ��ϼ������غ�������غ���ƽ���̣��������ӷ���ʽ���㣻
��1��![]() ����Һ����Ϊ
����Һ����Ϊ![]() ������Һ���Ϊ
������Һ���Ϊ ����
����![]() =
=![]() mol��L��1���ʴ�Ϊ��
mol��L��1���ʴ�Ϊ��![]() mol��L��1��
mol��L��1��
��2����ԭ��Fe2+>Br��ͨ�������ȷ�����Ӧ![]() ��Fe2+��Ӧ��ϣ�ʣ��������ٷ�����Ӧ
��Fe2+��Ӧ��ϣ�ʣ��������ٷ�����Ӧ![]() ����Ӧ����Һ��Cl��Br�����ʵ���Ũ����ȣ�˵��������ȫ��Ӧ��Cl2�����ʵ���Ϊ
����Ӧ����Һ��Cl��Br�����ʵ���Ũ����ȣ�˵��������ȫ��Ӧ��Cl2�����ʵ���Ϊ![]() ����
����![]() ���ʴ�Ϊ��2mol/L��
���ʴ�Ϊ��2mol/L��
��3��FeCl3��Һ����������ˮ���侻ˮ��ԭ��Ϊ![]() ��100mL2molL1��FeCl3��Һ�������ʵ���Ϊ0.2mol����Ϊˮ��Ϊ���淴Ӧ�������ɽ���Ϊ�����ӵļ����壬�����ɾ��о�ˮ���õ�����С��0.2NA���ʴ�Ϊ��
��100mL2molL1��FeCl3��Һ�������ʵ���Ϊ0.2mol����Ϊˮ��Ϊ���淴Ӧ�������ɽ���Ϊ�����ӵļ����壬�����ɾ��о�ˮ���õ�����С��0.2NA���ʴ�Ϊ��![]() ��С�ڣ�
��С�ڣ�
��4��ClO2��CN��������ֻ��������������N2��CO2�������ӷ���ʽΪ��![]() ��100m3������ˮ��CN������Ϊ
��100m3������ˮ��CN������Ϊ![]() ����CN�����ʵ���
����CN�����ʵ���![]() ������ҪClO2
������ҪClO2![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��

 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д� �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д�