题目内容
A、B、C、D、E五种短周期主族元素,原子序数依次增大。A原子的核外电子数等于最外层电子数;B原子的最外层电子数是次外层电子数的2倍;C原子的M层电子数与L层电子数相差7;D原子的最外层电子数是A、B、C三原子的最外层电子数之和。回答下列问题。
(1)元素B在周期表中的位置为第 周期 族;元素D简单离子的结构示意图为 。
(2)元素C、D简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)元素B可形成离子BH3-,下列与其具有相同电子数和质子数的微粒是 。
A.NH4+ B.OH- C.F- D.HS-
(4)元素A、C组成化合物甲CA,甲能与水反应产生一种强碱和一种气体,该反应的化学方程式为 。
(5)A元素有aA、a+1A、a+2A三种同位素,E元素有eE、e+2E两种同位素,二者所形成分子的相对分子质量有 种。
(13分)
(1)二(1分);ⅣA(1分);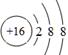 (2分)
(2分)
(2)S2- > Na+(2分)
(3)B C(2分)
(4)NaH + H2O =" NaOH" + H2↑(3分)
(5)5(2分)
解析试题分析:A原子的核外电子数等于最外层电子数,A为H元素;B原子的最外层电子数是次外层电子数的2倍,B为C元素;C原子的M层电子数与L层电子数相差7,C为Na元素;D原子的最外层电子数是A、B、C三原子的最外层电子数之和,D为S元素;E为Cl元素。
(1)B为C元素,在周期表中的位置为第二周期ⅣA族。D为S元素,原子序数是16,得到2个电子达到稳定结构,离子的结构示意图为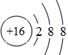 。
。
(2)C为Na元素,易失去一个电子达到稳定结构,电子层为2层,D为S元素,易得到2个电子达到稳定结构,电子层为3层,离子半径大小即S2- > Na+。
(3)注意离子电子数的计算,阴离子是得到电子而形成的,带负电荷,阳离子是原子失去电子而形成的,带正电荷。得失电子数等于其电荷数。
(4)A为H元素,C为Na元素,即CA为NaH,结合题中所给出的信息,方程式为NaH + H2O =" NaOH" + H2↑。
考点:原子结构与元素周期律的关系
点评:以原子结构与位置关系为载体,考查化学用语、物质结构、半径比较等,难度中等,推断元素是解题关键,是对所学知识的综合运用,注意基础知识的理解掌握。







 元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )