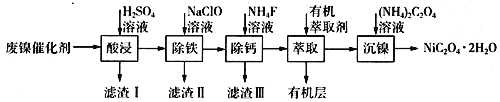
题目内容
【题目】以下六种物质是一个氧化还原反应的反应物和生成物:NO、FeSO4、H2O、Fe(NO3)3、HNO3和Fe2(SO4)3. 写出该反应方程式并配平,用单线桥标出电子转移方向与数目。____________________ ,该反应中,氧化剂是___________,被氧化的元素是___________,若产生标准状况下11.2L气体,转移电子数为____________。
【答案】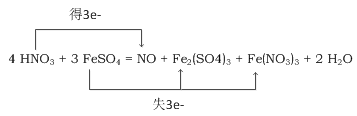 HNO3 Fe 1.5NA
HNO3 Fe 1.5NA
【解析】
根据氧化还原反应的基本规律,HNO3具有强氧化性,应该为反应物,则NO为生成物,反应中硝酸被还原,为氧化剂,则反应中FeSO4应为还原剂,被还原为Fe2(SO4)3和Fe(NO3)3,据此答题。
氧化还原反应的特征为化合价的升降,反应中HNO3为反应物,具有强氧化性,则NO为生成物,反应中硝酸被还原,为氧化剂,题给物质中元素化合价发生变化的还有Fe,则Fe元素化合价应升高,被氧化,则FeSO4应为还原剂,被氧化生成Fe2(SO4)3和Fe(NO3)3,根据电子守恒,氮元素的化合价降低了3价,铁元素化合价升高了1价,根据得失电子守恒以及元素守恒,所以硫酸亚铁前边系数是3,硝酸前系数是4,水的前边系数是2,反应方程式为:4HNO3+3FeSO4=Fe2(SO4)3+Fe(NO3)3+NO↑+2H2O,用单线桥标出电子转移方向与数目为: ,NO的物质的量是11.2L÷22.4L/mol=0.5mol,反应中氮元素的化合价从+5价降低到+2价,得到3个电子,因此反应中转移电子的个数是1.5NA,故答案为:
,NO的物质的量是11.2L÷22.4L/mol=0.5mol,反应中氮元素的化合价从+5价降低到+2价,得到3个电子,因此反应中转移电子的个数是1.5NA,故答案为:
 ,HNO3,Fe,1.5NA。
,HNO3,Fe,1.5NA。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目