题目内容
金属钛被称为铁和铝之后崛起的第三金属,它是空间技术、航海、化工、医疗上不可缺少的材料。
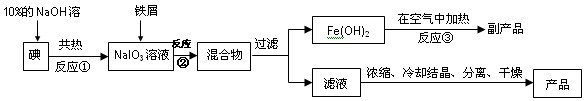
I、工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:_________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的离子方程式 。
II、为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示。
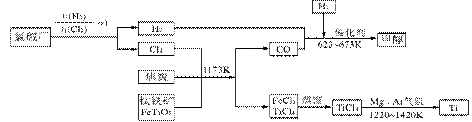
(3)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________________________。
(4)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=一641 kJ·mol-1
②1/2Ti(s)+Cl2(g)=1/2TiCl4(l);△H=一385 kJ·mol-1
则Mg 与TiCl4反应的热化学方程式为 ,
该反应在氩气氛中进行的理由是 。
(5)在上述产业链中,合成192 t 甲醇理论上需额外补充H2 t (不考虑生产过程中物质的任何损失)。
I、工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:_________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的离子方程式 。
II、为了提高资源的利用率,减少环境污染,可将氯碱厂、炼钛厂和甲醇厂组成产业链,其关系如下图所示。

(3)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________________________。
(4)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=一641 kJ·mol-1
②1/2Ti(s)+Cl2(g)=1/2TiCl4(l);△H=一385 kJ·mol-1
则Mg 与TiCl4反应的热化学方程式为 ,
该反应在氩气氛中进行的理由是 。
(5)在上述产业链中,合成192 t 甲醇理论上需额外补充H2 t (不考虑生产过程中物质的任何损失)。
I.(1)不需要(2)Al2O3+2OH—=2Al O2—+H2O SiO2+2OH—=SiO32—+H2O
II.(3)2FeTiO3+6C+7Cl2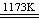 2FeCl3+2TiCl4+6CO
2FeCl3+2TiCl4+6CO
(4)2Mg(s)+TiCl4(l) ="==" 2MgCl2(s)+Ti(s);△H=-512 kJ·mol-1
Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化(5)10(3分)
II.(3)2FeTiO3+6C+7Cl2
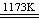 2FeCl3+2TiCl4+6CO
2FeCl3+2TiCl4+6CO (4)2Mg(s)+TiCl4(l) ="==" 2MgCl2(s)+Ti(s);△H=-512 kJ·mol-1
Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化(5)10(3分)
略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 是一种重要的化工原料,工业上生产硝酸的主要过程如下:
是一种重要的化工原料,工业上生产硝酸的主要过程如下: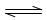 2NH3(g) △H<0
2NH3(g) △H<0 ,则N2的转化率a1= ;
,则N2的转化率a1= ;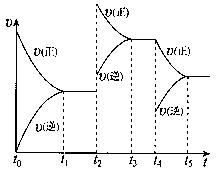
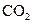 含量高的水浇灌农作物有许多优点,下列对其优点的分析不正确的是( )
含量高的水浇灌农作物有许多优点,下列对其优点的分析不正确的是( ) 科学院宣布,将2007年诺贝尔化学奖授予德国马普学会弗里茨-哈伯(Fritz-Haber)研究所的格哈德·埃特尔(Gerhard Ertl)教授,以表彰他在固体表面化学过程研究领域作出的开拓性成就。合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
科学院宣布,将2007年诺贝尔化学奖授予德国马普学会弗里茨-哈伯(Fritz-Haber)研究所的格哈德·埃特尔(Gerhard Ertl)教授,以表彰他在固体表面化学过程研究领域作出的开拓性成就。合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。 =4FeO +CO2↑,为制得这种催化活性最高的催化剂,应向480g Fe2O3粉末中加入碳粉的质量为_________ g。
=4FeO +CO2↑,为制得这种催化活性最高的催化剂,应向480g Fe2O3粉末中加入碳粉的质量为_________ g。 2NH3(g) ,在反应过程中,
2NH3(g) ,在反应过程中, t1、t2、t3、t4时条件改变,正反应速率发生变化,如右图,对于可能的条件改变下列判断正确的是
t1、t2、t3、t4时条件改变,正反应速率发生变化,如右图,对于可能的条件改变下列判断正确的是