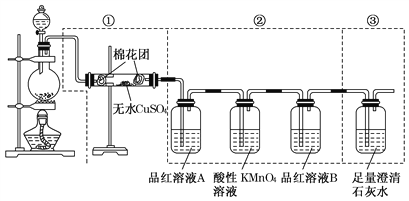
题目内容
【题目】已知在25 ℃条件下向10.00 mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如下图所示(忽略温度变化)。下列说法中不正确的是( )
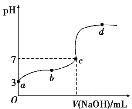
A.a点表示的溶液中c(CH3COO-)约为10-3 mol·L-1
B.用25 .00mL的酸式滴定管量取CH3COOH溶液
C.c点NaOH溶液的体积小于10 mL
D.在a、c间任一点,溶液中一定都有c(Na+)>cCH3COO-)>c(H+)>c(OH-)
【答案】D
【解析】
试题分析:A.由于甲酸中水电离的氢离子浓度很小,所以溶液中氢离子浓度与甲酸电离的甲酸根离子浓度基本相等,a点时溶液pH=3,氢离子浓度为10-3 molL-1,则甲酸溶液中甲酸根离子浓度约为10-3 molL-1,故A正确;B.甲酸为一元弱酸,溶液显示酸性,所以取用甲酸应该使用酸式滴定管,故B正确;C.由于甲酸为弱酸,若加入10mL氢氧化钠溶液时,反应生成强碱弱酸盐甲酸钠,反应后的溶液为碱性,由于c点显示中性,则加入的氢氧化钠溶液体积应该小于10mL,故C正确;D.在a、c间任一点,溶液显示酸性,则一定满足:c(H+)>c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(HCOO-)+c(OH-)可知,c(Na+)<c(HCOO-),所以离子浓度正确关系为:c(HCOO-)>c(Na+)>c(H+)>c(OH-),故D错误;故选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目