题目内容
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___________(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=______。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是____(填“A” 或“B ”)。
【答案】CO32- 10 +120 kJ·mol-1 B
【解析】
(1)溶液pH=13,碱性强,所以CO2主要转化为CO32-;若所得溶液c(HCO3)∶c(CO32)=2∶1,根据第二步电离常数进行计算;
(2)ΔH=Q(吸)-Q(放);正反应为气体体积增大的吸热反应,所以温度越高越有利于反应正向进行,吸热越多;
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为CO32-;若所得溶液c(HCO3)∶c(CO32)=2∶1,K2=5×1011=![]() =
=![]() ×C(H+)得出C(H+)=10-10,所以PH=10;
×C(H+)得出C(H+)=10-10,所以PH=10;
正确答案:CO32- 10。
(2)ΔH=4×413+2×745-2×1075-2×436=+120 kJ·mol-1;CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)正反应为气体体积增大的吸热反应,所以压强越小越有利于反应正向进行,吸热越多,应该选B;
2CO (g)+ 2H2(g)正反应为气体体积增大的吸热反应,所以压强越小越有利于反应正向进行,吸热越多,应该选B;
正确答案:+120 kJ·mol-1 B。

【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
组分 | SiO2 | MgO | Na2O | K2O | Fe2O3 |
质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.8 |
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
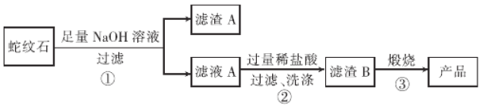
(1)蛇纹石中涉及的可溶性金属氧化物有____________(写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为________________。
(3)滤渣A 的成分有______________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_____________________。
(5)步骤③反应的化学方程式为______________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、和________________。