题目内容
【题目】请根据所学知识回答下列问题:
(1)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1△H2 .
①P4(白磷,s)+5O2(g)═2P2O5(s)△H1
②4P(红磷,s)+5O2(g)═2P2O5(s)△H2
(2)已知:稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJmol﹣1 , 则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量57.3kJ.
(3)已知:C3H8(g )═CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJmol﹣1
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=32.4kJmol﹣1
则相同条件下,反应C3H8(g)═CH3CH=CH2 (g)+H2(g)的△H=kJmol﹣1
(4)如图是一种钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,其作用是导电和隔膜,该电池反应为2Na+xS=Na2Sx . 该电池正极的电极反应式为 .
用该电池作电源进行铁件镀铜时,若电镀池中两电极的质量开始相同,电镀完成后取出洗净、烘干、称量,二者质量差为25.6g,则理论上该电池负极消耗的质量为g.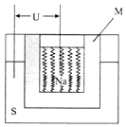
【答案】
(1)<
(2)>
(3)+124.2
(4)xS+2e﹣=Sx2﹣;9.2
【解析】解:(1)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多,因△H<0,则放出的能量越多反应热越小,所以答案是:<;(2)浓硫酸溶于水放热,放出的热量多余57.3kJ,所以答案是:>;(3)①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJmol﹣1②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJmol﹣1
依据盖斯定律①﹣②得到C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+124.2KJ/mol
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+124.2KJ/mol;
所以答案是:+124.2;(4)原电池正极发生得电子的还原反应,在反应2Na+xS=Na2Sx中,硫单质得电子,故正极反应为:xS+2e﹣=Sx2﹣;
电镀时,镀层作阳极、镀件作阴极,所以阳极上铜失电子发生氧化反应,电极反应式为Cu﹣2e﹣=Cu2+ , 阴极上铜离子得电子发生还原反应,阴极反应式为Cu2++2e﹣=Cu;电镀后,两个电极质量差等于阳极溶解质量与阴极析出质量之和,若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为25.6g,所以阳极溶解铜的质量为12.8g,
设通过的电子为x,
Cu | ﹣ | 2e﹣ | =Cu2+ |
64g | 2mol | ||
12.8g | x |
64g:2mol=12.8g:x,
x=0.4mol,
故流经电镀池的电极的电子的物质的量为0.4mol,而流经电镀池的电子的量与流经原电池中正负极的电子的量相同,设原电池负极上有Xg钠被消耗,有:
Na | ﹣ | e﹣ | = Na+ |
23g | 1mol | ||
Xg | 0.4mol |
可得 X= ![]() ,
,
解得X=9.2g
所以答案是:xS+2e﹣=Sx2﹣;9.2.
【考点精析】本题主要考查了反应热和焓变的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热才能正确解答此题.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】下列物质的化学性质与实际应用对应关系正确的是( )
化学性质 | 实际应用 | |
A | NH3具有碱性 | 用作制冷剂 |
B | SO2是酸性氧化物 | 用于纸张漂白 |
C | 漂白粉具有氧化性 | 用于漂白织物 |
D | FeCl3能与碱溶液反应 | 用于蚀刻铜制线路板 |
A.AB.BC.CD.D