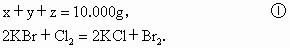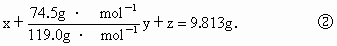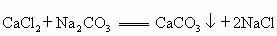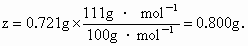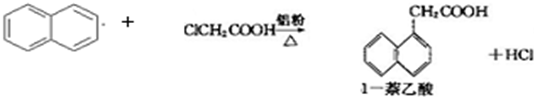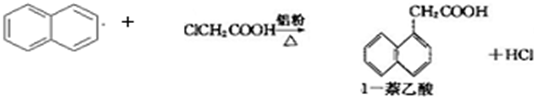题目内容
将10.000g氯化钠、溴化钾和氯化钙的混合物溶于水中,通入足量氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼烧后残留物的质量为9.813g,若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为0.721g.求原混合物中各化物的质量.(按氯化钠、溴化钾和氯化钙顺序回答)
答案:8.700g,0.500g,0.800g$8.700克,0.500克,0.800克
解析:
解析:
|
NaCl 为8.700g;KBr为0.500g,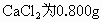
设混合物中各物的质量: NaCl为x,KBr为y,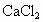 为z. 为z.
混合物中 KBr转化为KCl,灼烧后溴全部挥发,因此:
由①、②得: 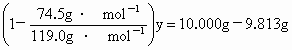
解得 y=0.500g.残留物溶于水后加入足量碳酸钠溶液,发生如下反应:
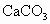 的质量可以算出 的质量可以算出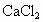 的质量: 的质量:
氯化钠的质量为: x=10.000g -0.500g-0.800g=8.700g. |

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
1-萘乙酸(分子式C12H10O2),是白色针状晶体,常用做植物生长调节剂.
已知:
以萘和氯乙酸为原料生产1-萘乙酸的原理如下: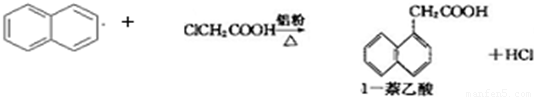
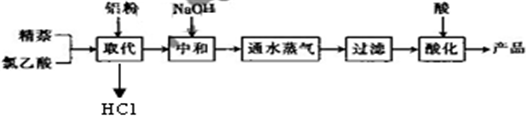
生产的主要流程为:
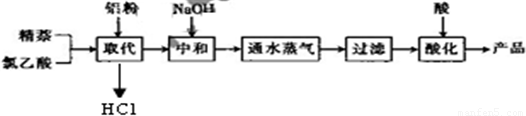
(1)上述流程中,通入水蒸气的作用除了蒸出过量的蒸外,还可能有______.
(2)结合生产原理分析,生产中可循环利用的物质是______(填化学式).
(3)测定样品中1-蒸乙酸含量的方法如下:
a、积取10.000g样品,溶解在含3.200gNaOH中的水溶液中,充分反应;
b、将反应后的溶液转移至250mL容量瓶中,定容.
C、量取25.00mL待测溶液于锥形瓶中;
d、用0.1000mL的盐酸滴定过量的NaOH至终点,消耗盐酸体积的平均值为2800Ml;
①上述测定过程中,c、d之间还缺少的操作是______.
②若用上述方法测定的样品中1-萘乙酸的质量分数偏高(测定过程中产生的误差可忽略),则其主要原因可能是______.
(4)产品1-萘乙酸可能含有氯化铝、萘、氯乙酸等杂质,请你设计一个简单的实验方案提纳1-萘乙酸;
填写下列表格中的空白栏:
已知:
| 有机物\物理性质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 1-萘乙酸 | 134.5 | 285(分解) | 易溶于热水,难溶于冷水,易溶于碱 |
| 萘 | 80.5 | 219.9 | 不溶于热水 |
| 氯乙酸 | 62 | 189 | 溶于水 |
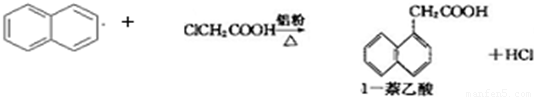
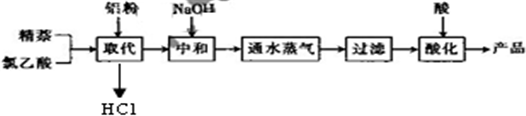
生产的主要流程为:

(1)上述流程中,通入水蒸气的作用除了蒸出过量的蒸外,还可能有______.
(2)结合生产原理分析,生产中可循环利用的物质是______(填化学式).
(3)测定样品中1-蒸乙酸含量的方法如下:
a、积取10.000g样品,溶解在含3.200gNaOH中的水溶液中,充分反应;
b、将反应后的溶液转移至250mL容量瓶中,定容.
C、量取25.00mL待测溶液于锥形瓶中;
d、用0.1000mL的盐酸滴定过量的NaOH至终点,消耗盐酸体积的平均值为2800Ml;
①上述测定过程中,c、d之间还缺少的操作是______.
②若用上述方法测定的样品中1-萘乙酸的质量分数偏高(测定过程中产生的误差可忽略),则其主要原因可能是______.
(4)产品1-萘乙酸可能含有氯化铝、萘、氯乙酸等杂质,请你设计一个简单的实验方案提纳1-萘乙酸;
填写下列表格中的空白栏:
| 实验方法和操作 | 实验目的 |
| 1.把产品放入容器中,加入适量的蒸馏水,加热并充分搅拌; | ______ |
| 2.______ | 除去杂质萘; |
| 3.______,再过滤,洗涤,干燥. | 得到提纯的产品1-萘乙酸. |