��Ŀ����
����Ŀ����̽�ն�Ա��-���ᣬ��С���߽��˻�ѧ�Թ�����֪�����߳�������Ϊ�Թ��������˵�Ұ���������������ᷴӦ�����ʻ�����ˮ��Һ)���������ܿ����ǣ��������ͨ����

��1���������Ե�������Ļ�ѧ��Ӧ�У���������кͷ�Ӧ����_____��������������ԭ��Ӧ����______�������������Ե������������_________(�ѧʽ)��д���÷�Ӧ�����ӷ���ʽ__________________��
��2���ڲ��������ᷴӦ�������У����ڵ���ʵ���__________(��д������ţ���ͬ)�����ڷǵ���ʵ���_______________��
��3������������߳��Թ�(��ͼ������ǰ���������������ʾ���ߵ�·��)_______________________��
���𰸡� 2 1 Na2CO3 CO32- +2H+=CO2��+H2O �� �ۢ� ������������������
��������
��1���кͷ�Ӧ������Ӧ�����ݼ������ȷ���кͷ�Ӧ�ĸ���������2�֣����������ƺ��������ƣ����кͷ�Ӧ��2�����������ᷴӦ���ϼ۷����仯��ֻ��п��������������ԭ��Ӧֻ��1�����������ᷴӦ����ֻ��Na2CO3��̼���ƺ����ᶼ����ǿ����ʣ�����Һ����ȫ���룬��Ӧ���ɶ�����̼�����ˮ����Ӧ�����ӷ���ʽΪCO32-+2H+=CO2��+H2O����2���������Ӧ���ж�����̼�������ý���ͭ�������Ȼ��ơ������������ᣬ
������̼�Ͷ��������������ܵ��룬���ڷǵ���ʣ�ͭ�����ǽ������ʣ��Ȳ��ǵ����Ҳ���Ƿǵ���ʣ��Ȼ�����ˮ��Һ�л�����״̬���ܹ����磬���ڵ���ʣ�������ˮ��Һ���ܹ����磬���ڵ���ʣ������ڵ���ʵ��ǣ����Ȼ��ƣ�������ڷǵ���ʵ��ǣ��۶�����̼�������������3������ͼʾ�����ʶ���ص�������ܷ�Ӧ�����������жϼ��ɣ���������ܺͶ�����̼�������������ᡢͭ�����ȷ�Ӧ���߳��Թ����ߵ�·��Ϊ�ۡ��ޡ�����ߡ�����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��һ���¶��£���10 mL 0.40 mol��L��1 H2O2��Һ�м�������FeCl3��Һ����ͬʱ�̲������O2�����(������Ϊ��״��)���±���ʾ��
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
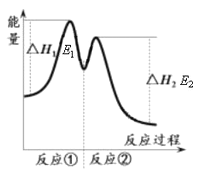
������ʾ����Ӧ���������У��� 2Fe3+��H2O2 == 2Fe2+��O2����2H+���� H2O2��2Fe2+��2H+ == 2H2O��2Fe3+����Ӧ�����������仯����ͼ��ʾ������˵���������
A. Fe3+�������������������ķֽ�����
B. ��Ӧ�������ȷ�Ӧ����Ӧ���Ƿ��ȷ�Ӧ
C. ��Ӧ2H2O2(aq) == 2H2O(l)��O2(g)����H��E1��E2��0
D. 0��6 min��ƽ����Ӧ���ʣ�v(H2O2)��3.33��10��2 mol��L��1��min��1