题目内容
3.现代传感信息技术在化学实验中有广泛的应用.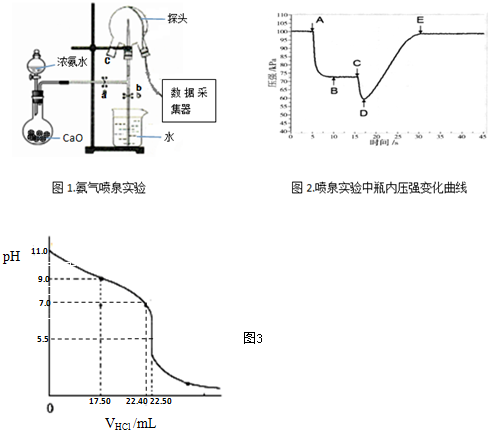
某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1).
(1)制取氨气.烧瓶中制取NH3的化学方程式为NH3•H2O+CaO=Ca(OH)2+NH3↑,检验三颈瓶集满NH3的方法是将湿润的红色石蕊试纸靠近瓶口c,试纸变蓝色,证明NH3已收满;或:将蘸有浓盐酸的玻璃棒靠近瓶口c,有白烟生成,证明NH3已收满.
(2)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2).图2中D点时喷泉最剧烈.
测定NH3•H2O的浓度及电离平衡常数Kb
(3)从三颈瓶中用碱式滴定管(或移液管)(填仪器名称)量取25.00mL氨水至锥形瓶中,用0.0500mol•L-1HCl滴定.用pH计采集数据、电脑绘制滴定曲线如下图.
(4)据图,计算氨水的浓度为0.045mol•L-1;写出NH3•H2O电离平衡常数Kb的表达式,Kb=$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$,当pH=11.0时计算Kb的近似值,Kb≈2.2×10-5.
(5)关于该滴定实验的说法中,正确的是AC.
A.锥形瓶中有少量蒸馏水不影响测定结果
B.未滴加酸碱指示剂,实验结果不科学
C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高
D.滴定终点时俯视读数会导致测得氨水的浓度偏高.
分析 Ⅰ.(1)CaO和水反应生成氢氧化钙且放出热量,放出的热量促进一水合氨分解,据此书写方程式;
氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而导致氨水溶液呈碱性,红色石蕊试液遇碱蓝色,氨气也能和HCl反应生成白烟;
(2)三颈瓶内气体与外界大气压压强之差越大,其喷泉越剧烈;
Ⅱ.(3)可以用移液管或碱式滴定管量取碱性溶液;
(4)根据图知,当氨水和稀盐酸恰好完全反应时混合溶液的pH值为3.5,此时存在c(HCl)×V(HCl)=c(NH3)×V(NH3);
弱电解质电离平衡常数Kb=$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$;pH=11的氨水中c(OH-)=0.001mol/L,c(OH-)≈c(NH4+)=0.001mol/L,c(NH3•H2O)≈0.0450mol/L,根据Kb=$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$计算电离平衡常数;
(5)A.锥形瓶中有少量蒸馏水不影响氨水的物质的量;
B.利用pH计判断滴定终点更准确;
C.酸式滴定管未用盐酸润洗会导致盐酸浓度偏低;
D.滴定终点时俯视读数会导致盐酸物质的量偏小.
解答 9解:Ⅰ.(1)CaO和水反应生成氢氧化钙且放出热量,放出的热量促进一水合氨分解,该反应方程式为NH3•H2O+CaO=Ca(OH)2+NH3↑;
氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而导致氨水溶液呈碱性,红色石蕊试液遇碱蓝色,氨气也能和HCl反应生成白烟,所以氨气的检验方法为:将湿润的红色石蕊试纸靠近瓶口c,试纸变蓝色,证明NH3已收满;或:将蘸有浓盐酸的玻璃棒靠近瓶口c,有白烟生成,证明NH3已收满;
故答案为:NH3•H2O+CaO=Ca(OH)2+NH3↑;
将湿润的红色石蕊试纸靠近瓶口c,试纸变蓝色,证明NH3已收满;或:将蘸有浓盐酸的玻璃棒靠近瓶口c,有白烟生成,证明NH3已收满;
(2)三颈瓶内气体与外界大气压压强之差越大,其反应速率越快,D点压强最小、大气压不变,所以大气压和D点压强差最大,则喷泉越剧烈,故答案为:D;
Ⅱ.(3)氨水中含有一水合氨,一水合氨电离出氢氧根离子而使溶液呈碱性,所以用移液管或碱式滴定管量取氨水,故答案为:碱式滴定管(或移液管);
(4)根据图知,当氨水和稀盐酸恰好完全反应时混合溶液的pH值为3.5,此时存在c(HCl)×V(HCl)=c(NH3)×V(NH3),0.0500mol/L×0.0225L=c(NH3)×0.025L,c(NH3)=0.045mol/L;
弱电解质电离平衡常数Kb=$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$;pH=11的氨水中c(OH-)=0.001mol/L,c(OH-)≈c(NH4+)=0.001mol/L,c(NH3•H2O)≈0.0450mol/L,根据Kb=$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{0.001×0.001}{0.045}$=2.2×10-5;
故答案为:0.045;$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$;2.2×10-5;
(5)A.锥形瓶中有少量蒸馏水不影响氨水的物质的量,所以不影响测定结果,故A正确;
B.利用pH计判断滴定终点更准确,不需要酸碱指示剂即可,故B错误;
C.酸式滴定管未用盐酸润洗会导致盐酸浓度偏低,则使用盐酸的体积偏大,所以导致测定结果偏高,故C正确;
D.滴定终点时俯视读数会导致盐酸体积偏小,则盐酸物质的量偏小,测定结果偏低,故D错误.
故选AC.
点评 本题考查性质实验方案设计,侧重考查学生分析、判断及实验操作能力,明确滴定原理、喷泉实验原理、弱电解质电离等知识点是解本题关键,(5)题A为易错点,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 石油分馏 | |
| B. | 煤的干馏 | |
| C. | 苯中加入溴水 | |
| D. | 煤焦油中提取苯、甲苯、二甲苯等产物 |
| A. | 26Fe的价层电子排布式为3d64s2 | |
| B. | 35Br的电子排布式可简写为[Ar]4s24p5 | |
| C. | NH4Cl的电子式为 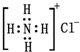 | |
| D. | 氯离子结构示意图为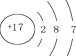 |
CH3OH(l)=CH4(g)+$\frac{1}{2}$O2(g)△H=b kJ•mol一1
CO2(g)+2H2O(g)=CH3OH(l)+$\frac{3}{2}$O2(g)△H=+638.5 kJ•mol一1
则下列叙述正确的是( )
| A. | 甲烷的燃烧热为a kJ•mol-1 | B. | a一定大于0 | ||
| C. | a+b=-638.5 | D. | b一定小于0 |
| 阳离子 | K+、Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
①A、C溶液的pH均大于7,B溶液的pH小于7,A、B的溶液中水的电离程度相同;D溶液焰色反应(透过蓝色钴玻璃)显紫色.
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象.
(1)A的化学式:CH3COONa.
(2)用离子方程式表示B的水溶液pH小于7原因NH4++H2O?NH3•H2O+H+.
(3)写出C溶液和D溶液反应的离子方程式Ba2++SO42-=BaSO4↓.
(4)pH=10的A溶液和pH=10的C溶液中水的电离程度大的是CH3COONa(填写A或C的化学式).
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
| X | ||
| M |
乙(g)+Z2(g)→甲(g)+Q2(g),每生成1mol Q2放热57.8kJ.写出该反应的热化学方程式:2HCl(g)+$\frac{1}{2}$O2(g)=H2O(g)+Cl2(g)△H=-57.8 kJ/mol或4HCl(g)+O2(g)=2H2O(g) 2Cl2(g)△H=-115.6 kJ/mol;
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式说明)NH4++H2O?NH3.H2O+H+;该溶液中各种离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(3)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:
2CO+2NO
 N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;(4)将1mol丙气体和1mol丁气体充入装有催化剂的恒压容器中,充分反应达平衡后:①若气体体积较原来减少23%,则丁的转化率为92%;
②已知该反应△H<0,则升高温度,平衡常数K值将变小(填变大、变小或不变);
③若仅将压强增大为原来的2倍,再次达平衡后,混合气体中丁的体积分数将变小(填变大、变小或不变).
(5)由X的最简单气态氢化物、Z的单质和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为CH4+10OH--8e-=CO32-+7H2O.
| A. | 离子半径:r(Y2-)>r(Z2+) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物弱 | |
| D. | X、Y、Z、W所有元素的最高正价等于其所在族的族序数 |
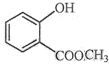 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.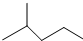 表示的分子式为C6H14;2-甲基-2-丁烯的结构简式为CH3C (CH3)=CHCH3.
表示的分子式为C6H14;2-甲基-2-丁烯的结构简式为CH3C (CH3)=CHCH3. .
.