题目内容
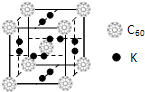
[化学-选修物质结构与性质]已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期也不在同一主族.B原子的L层有1对成对电子且其单质是空气的主要成分.C原子的L层p轨道中有5个电子;D是周期表中1--18列中的第14列元素;D元素原子次外层电子数与最外层电子数之比为4:1. E跟C可形成离子化合物,其晶胞结构如右图.请回答:
(1)A与D形成的最简单化合物的分子式是 ,该分子的立体构型是 .该分子属于 (填“极性”或“非极性”)分子
(2)C与D形成的化合物晶体类型是 .B单质分子中含 个σ键 个π键
(3)C的电子排布图
(4)从上图中可以看出,E踉C形成的化合物的化学式为 ;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是 (只要求列出算式).
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
①估计钙元素的电负性的取值范围: <X<
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于17时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlC13中形成的化学键的类型及其理由是 .

【答案】分析:B原子的L层有1对成对电子且其单质是空气的主要成分,所以B为N元素.C原子的L层p轨道中有5个电子,所以C为F元素.D是周期表中1--18列中的第14列元素,即为碳族元素,且D元素原子次外层电子数与最外层电子数之比为2:1,所以D为Si元素.E跟C可形成离子化合物,根据晶胞结构可知晶胞中C原子与E原子个数之比为2:1,C为F元素,其离子为-1价,E离子为+2价,又由于A、B、C、D和E为前20号的元素,原子序数依次增大,故E为Ca元素.A与其他4种元素既不在同一周期也不在同一主族,所以A为H元素.故A为H元素,B为N元素,C为F元素,D为Si元素,E为Ca元素.
解答:解:(1)A为H元素,D为Si元素,所以A与D形成的最简单化合物为SiH4.SiH4中Si成4个δ键,最外层电子全部参与成键,立体构型是正四面体.SiH4立体构型是正四面体,为对称结构,正负电荷重心重合,为非极性分子.
故答案为:SiH4; 正四面体; 非极
(2)C为F元素,D为Si元素,形成的化合物为SiF4,都是非金属元素,所以为分子晶体.
B为N元素,其单质为N2,两个N原子以三键结合,含有1个σ键,2个π键.
故答案为:分子晶体;1;2
(3)C为F元素,核外有7个电子,其电子排布图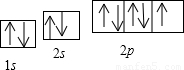 .
.
故答案为: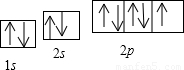
(4)C为F元素,E为Ca元素,由晶胞结构可知晶胞中F-离子数为8,Ca2+离子数为8× +6×
+6× =4,F-与Ca2+离子个数比为2:1,所以化学式为CaF2.
=4,F-与Ca2+离子个数比为2:1,所以化学式为CaF2.
该晶胞中相当于含有4个CaF2分子,CaF2的摩尔质量为78g/mol.所以1个CaF2晶胞的质量为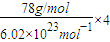
晶胞的体积为a3cm3.所以CaF2的密度为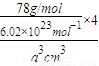 .
.
故答案为:CaF2;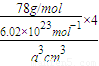 .
.
(5)①同一周期从左至右,有效核电荷递增,原子半径递减,对电子的吸引能力渐强,因而电负性值递增;同族元素从上到下,随着原子半径的增大,元素电负性值递减.钙元素的电负性的取值范围:0.8<X<1.2.
故答案为:0.8<X<1.2.
②AlCl3中氯与铝的电负性差值为1.5小于1.7,故AlCl3中化学键为共价键
故答案为:共价键,因为AlCl3中氯与铝的电负性差值为1.5小于1.7,故AlCl3中化学键为共价键.
点评:考查化学键、分子结构与极性问题、晶胞、电负性等,难度中等,关键根据题干推出各元素,利用所学知识进行解答.
解答:解:(1)A为H元素,D为Si元素,所以A与D形成的最简单化合物为SiH4.SiH4中Si成4个δ键,最外层电子全部参与成键,立体构型是正四面体.SiH4立体构型是正四面体,为对称结构,正负电荷重心重合,为非极性分子.
故答案为:SiH4; 正四面体; 非极
(2)C为F元素,D为Si元素,形成的化合物为SiF4,都是非金属元素,所以为分子晶体.
B为N元素,其单质为N2,两个N原子以三键结合,含有1个σ键,2个π键.
故答案为:分子晶体;1;2
(3)C为F元素,核外有7个电子,其电子排布图
 .
.故答案为:

(4)C为F元素,E为Ca元素,由晶胞结构可知晶胞中F-离子数为8,Ca2+离子数为8×
 +6×
+6× =4,F-与Ca2+离子个数比为2:1,所以化学式为CaF2.
=4,F-与Ca2+离子个数比为2:1,所以化学式为CaF2.该晶胞中相当于含有4个CaF2分子,CaF2的摩尔质量为78g/mol.所以1个CaF2晶胞的质量为
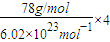
晶胞的体积为a3cm3.所以CaF2的密度为
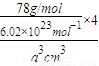 .
.故答案为:CaF2;
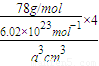 .
.(5)①同一周期从左至右,有效核电荷递增,原子半径递减,对电子的吸引能力渐强,因而电负性值递增;同族元素从上到下,随着原子半径的增大,元素电负性值递减.钙元素的电负性的取值范围:0.8<X<1.2.
故答案为:0.8<X<1.2.
②AlCl3中氯与铝的电负性差值为1.5小于1.7,故AlCl3中化学键为共价键
故答案为:共价键,因为AlCl3中氯与铝的电负性差值为1.5小于1.7,故AlCl3中化学键为共价键.
点评:考查化学键、分子结构与极性问题、晶胞、电负性等,难度中等,关键根据题干推出各元素,利用所学知识进行解答.

练习册系列答案
相关题目
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质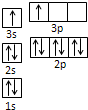
 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]