题目内容
【题目】已知有关热化学方程式为:
① 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905kJ/mol;
4NO(g)+6H2O(g) △H=-905kJ/mol;
② 3H2(g)+N2(g)![]() 2NH3(g) △H=-92.4kJ/mol;
2NH3(g) △H=-92.4kJ/mol;
③ 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol;
④ N2(g)+O2(g)=2NO(g) △H=QkJ/mol;
(1)Q=___________。
(2)向某密闭容器中充入amolNH3、bmolO2后,测得反应体系中某种量值X与压强P、温度T之间的变化如图1所示,图2表示温度为T2时,当容器为1L恒容密闭容器时,容器中NH3的平衡转化率与反应开始时两种反应物的投料之比(用M表示)的关系。
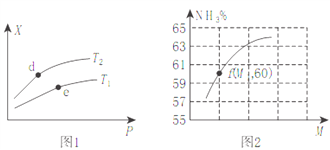
①若X表示NH3的百分含量,则T2_____T1(填>、<、无法确定);d、e两点的正反应的平衡常数K(d)_____K(e)。
②X还可以表示_____________。
a.混合气体的平均摩尔质量 b.NO的产率 c.△H值
③M=__________(用含a、b的式子表示,后同),若f点M=1.25,则此时O2的转化率为_________
(3)有科学家电解原理获得高产率的合成氨,则阴极上的电极反应式为(已知电解质能传递H+)_______________。
【答案】 +180.5 > < a b/a 60% N2+6e-+6H+=2NH3
【解析】(1)根据盖斯定律可知:[①-3×③+2×②]÷2可得:N2(g)+O2(g)=2NO(g), △H=. +180.5 kJ/mol;正确答案:+180.5。
(2) ①若X表示NH3的百分含量,该反应为放热反应,升高温度,平衡左移,NH3的百分含量增大,因此T2>T1;由于该反应放热,升高温度,平衡左移,平衡常数减小,温度d点大于 e点,因此d、e两点的正反应的平衡常数K(d)<k(e);正确答案:></k(e);正确答案:> ; <。
②该反应反应前后混合气体的总质量不变,增大压强,平衡左移,混合气体的总量减小,混合气体的平均摩尔质量增大;该反应放热,升高温度,平衡左移,混合气体的平均摩尔质量增大;a正确;增大压强,平衡左移,NO的产率降低,b错误;一个固定的反应,△H为定值,c错误;所以X可以表示混合气体的平均摩尔质量;正确选项a。
③根据4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-905kJ/mol可知,如果增大氧气的浓度,氨气的转化率增大;根据图像曲线变化可知,M=b/a,比值越大,氨气的转化率越高;根据M=b/a,若f点M=1.25可知,假设氧气为1.25mol, 则氨气为1mol,氨气的转化率为60%,则氨气变化了0.6mol,氧气变化了0.6×5/4=0.75mol, 则此时O2的转化率为0.75/1.25×100%=60%;正确答案:b/a 60%。
4NO(g)+6H2O(g) △H=-905kJ/mol可知,如果增大氧气的浓度,氨气的转化率增大;根据图像曲线变化可知,M=b/a,比值越大,氨气的转化率越高;根据M=b/a,若f点M=1.25可知,假设氧气为1.25mol, 则氨气为1mol,氨气的转化率为60%,则氨气变化了0.6mol,氧气变化了0.6×5/4=0.75mol, 则此时O2的转化率为0.75/1.25×100%=60%;正确答案:b/a 60%。
(3)氮气和氢气合成氨气,电解池中,氮气在阴极得电子,在酸性条件下变为氨气,电极反应式为:N2+6e-+6H+=2NH3;正确答案:N2+6e-+6H+=2NH3。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案