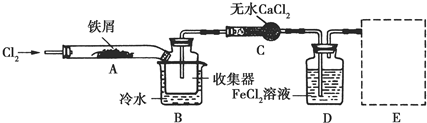
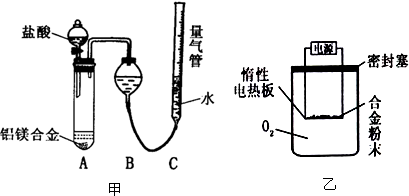
题目内容
6.在一定温度和压强下,5体积的气体A2和15体积的气体B2恰好反应生成10体积的气体C,则C的化学式为AB3或B3A,此题中应用了阿伏伽德罗定律定律和质量守恒定律定律.分析 相同条件下,体积之比等于物质的量之比等于分子数之比,据此判断反应方程式各物质的化学计量数,根据方程式原子守恒计算C的化学式.
解答 解:由于5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,阿伏伽德罗定律可知:其物质的量之比为1:3:2,则A2、B2、C的化学计量数之比为1:3:2,所以方程式为A2+3B2=2C,根据质量守恒定律可知C的化学式为AB3或B3A,
故答案为:AB3或B3A;阿伏伽德罗定律;质量守恒定律.
点评 本题考查了物质的量的计算,涉及阿伏伽德罗定律及推论、质量守恒定律的应用,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
16.球墨铸铁中含有一种铁碳化合物X.实验室测定化台物X的组成实验如下:
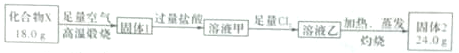
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 固体2是Fe2O3 | |
| B. | 溶液甲中可能含有Fe3+ | |
| C. | X的化学式可以表示为Fe3C2 | |
| D. | X与足量的热浓硝酸反应有NO2和CO2生成 |
17.若NA表示阿佛加德罗常数的值,下列说法正确的是( )
| A. | 1molCl2通入足量水中转移电子数为NA | |
| B. | 在0℃、101kPa时,22.4L H2中含有NA个H | |
| C. | 14gN2中含有7NA个电子 | |
| D. | NA个CO分子和0.5molCH4的质量比为7:4 |
14.以下物质间的转化通过一步反应都能实现的是( )
| A. | Cl2→HClO→NaClO | B. | Fe→Fe2O3→Fe(OH)3 | ||
| C. | S→SO3→H2SO4 | D. | NH3→NO2→HNO3→NaNO3 |
18.某有机物的结构简式如图.下列关于该有机物的叙述正确的是( )
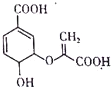

| A. | 分子中含有3种官能团 | |
| B. | 遇FeCl3溶液呈现为紫色 | |
| C. | 1mol该物质最多可与2molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
15.下列金属防腐的措施中,属于牺牲阳极的阴极保护法的是( )
| A. | 水中的钢闸门连接电源的负极 | B. | 地下钢管连接锌板 | ||
| C. | 汽水底盘喷涂高分子膜 | D. | 金属护拦表面涂漆 |
16.下列说法正确的是( )
| A. | 氢气的燃烧热为285.5KJ/mol,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$ 2H2(g)+O2(g)△H=+285.5KJ/mol | |
| B. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol 则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H=2×(-57.3)KJ/mol | |
| C. | 在CO2中,Mg燃烧生成MgO和C,该反应中化学能全都转化为热能 | |
| D. | 已知AX3的熔点和沸点分别为一93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 KJ/mol.该反应的热化学方程式为AX3(l)+X2(g)=AX5(s)△H=一123.8 KJ/mol |