��Ŀ����
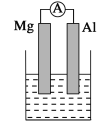
����Ŀ������ͼ�й�����ת����ϵ�У������ʾ��dz��л�ѧ���������ʣ�����AΪ��ɫ�������ʣ�B�ܲ���ֲ��Ĺ�����á�C��DΪ��ɫ��ĩ��FΪ�����ڸ������������ļGΪ���������ʣ�HΪ��������ɫ���ʣ�ͼ�в�����������ʡ�ԣ���

��1���û�ѧʽ��ʾ�� D________��G___________��
��2��д��E��F��Ӧ�Ļ�ѧ����ʽ________________________��
��3������������ɵĵ����������ڱ�������ǣ�C6H12O6������������ø�Ĵ������·�������������ͬʱ�ų�������д�������Ƿ�������������Ӧ�Ļ�ѧ����ʽ______________��
���𰸡�CBaSO4CuSO4+Ca(OH)2��Cu(OH)2��+CaSO4C6H12O6+6O2![]() 6CO2+6H2O
6CO2+6H2O
��������
���ݸ����ʾ��dz��л�ѧ���������ʣ�AΪ��ɫ�������ʣ�����A��ͭ��B�ܲ���ֲ��Ĺ�����ã�C��DΪ��ɫ��ĩ��C��D���»�����ͭ��B������B�Ƕ�����̼��C��D������ͭ��̼��C��X���ɵ�E�����Ȼ�����Ӧ������C������ͭ��D��̼��FΪ�����ڸ������������ļ����F���������ƣ�GΪ���������ʣ�HΪ��������ɫ���ʣ�����E������ͭ������ͭ���Ȼ�����Ӧ�������ᱵ�������Ȼ�ͭ������G�����ᱵ��X�����ᣬ����ͭ���������Ʒ�Ӧ��������ƺ�������ͭ����������H��������ͭ��I������ƣ�Ȼ���Ƴ������ʽ�����֤���ɡ�
�������Ϸ�����֪A��ͭ��B�Ƕ�����̼��C������ͭ��D��̼��E������ͭ��F���������ƣ�G�����ᱵ��X�����ᣬH��������ͭ��I������ƣ���
��1���������Ϸ�����֪D��G�Ļ�ѧʽ�ֱ���C��BaSO4��
��2��E��F�ķ�Ӧ���������ƺ�����ͭ��Ӧ��������ƺ�������ͭ��������ѧ����ʽΪCuSO4+Ca(OH)2��Cu(OH)2��+CaSO4��
��3����Ϊ�����Ƿ�������������Ӧ���ɶ�����̼��ˮ���ʻ�ѧ����ʽΪC6H12O6+6O2![]() 6CO2+6H2O��
6CO2+6H2O��

����Ŀ��25��ʱ��������������ˮ��Һ�еĵ�����ƽ�ⳣ�����������ѡ����ȷ���ǣ�������
�����ᣨHCN�� | ̼�ᣨH2C03�� | ����ᣨHF�� |
K=4.9��10��10 | K1=4.4��10��7 K2=4.7��10��11 | K=6.61��10��4 |
A. �軯����Һ��ͨ������CO2��2CN��+H2O+CO2�T2HCN+CO32��
B. NaCN��HCN�Ļ����Һ��һ���У�c��Na+����c��CN������c��HCN����c��H+����c��OH-��
C. 25��ʱCN-��ˮ��ƽ�ⳣ��ԼΪ1.6��10-5
D. NaCN��HCN�Ļ����Һ�У�2c(Na+)=c(CN����+c(HCN)
���𰸡�C
��������A�����ݵ���ƽ�ⳣ��֪������H2CO3��HCN��HCO3-�����ǿ����ȡ����֪���軯����Һ��ͨ������CO2ֻ�ܷ������·�ӦCN��+H2O+CO2=HCN+ HCO3-����A����B��NaCN��Һ�Լ��ԣ�HCN��Һ�����ԣ�ѡ����û����֪���ʱNaCN��HCN������Դ�С�����ж���Һ������ԣ�Ҳ���ж�����Ũ�ȴ�С����B����C��HCN�ĵ��볣��K��CN��ˮ�ⳣ��Kh�ij˻�����Kw������Kh=![]() ��1.6��10-5����C��ȷ��D���������Ũ�ȵ�NaCN��Һ��HCN��Һ���������Һ�������غ�Ϊ��2c(Na+)=c(CN)+c(HCN)����ѡ����û����֪NaCN��HCN������Դ�С�����жϣ���D����ѡC��
��1.6��10-5����C��ȷ��D���������Ũ�ȵ�NaCN��Һ��HCN��Һ���������Һ�������غ�Ϊ��2c(Na+)=c(CN)+c(HCN)����ѡ����û����֪NaCN��HCN������Դ�С�����жϣ���D����ѡC��
�����͡���ѡ��
��������
19
����Ŀ�������£���20.00 mL 0.8molL��1һԪ��HA��Һ�е���0.8 molL��1��NaOH��Һ����Һ��pH���¶������NaOH��Һ����ı仯������ͼ��ʾ�������й�˵����ȷ���ǣ�������
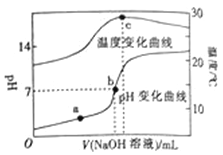
A. �����£�1.0 molL��1HA����Һ��pH=0
B. a��b��c���㣬a������Һ��c��Na+�����
C. a��b�������Һ��ˮ�����ӻ�Kw��a��=Kw��b��
D. c��ʱ����NaOH��Һ�����Ϊ20.00mL